- Аминокислоты
-
В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 10 апреля 2012.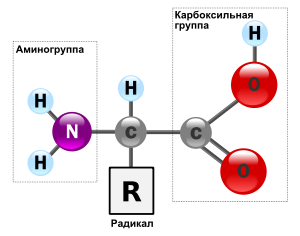 Общая структура α-аминокислот, составляющих белки (кроме пролина). Составные части молекулы аминокислоты — аминогруппа NH2, карбоксильная группа COOH, радикал (различается у всех α-аминокислот), α-атом углерода (в центре).
Общая структура α-аминокислот, составляющих белки (кроме пролина). Составные части молекулы аминокислоты — аминогруппа NH2, карбоксильная группа COOH, радикал (различается у всех α-аминокислот), α-атом углерода (в центре).
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Содержание
История
Открытие аминокислот в составе белков
Аминокислота аббревиатура Год Источник Кто впервые выделил[1] Глицин Gly 1820 Желатин А. Браконно Лейцин Leu 1820 Мышечные волокна А. Браконно Тирозин Tyr 1848 Казеин Ф. Бопп Серин Ser 1865 Шёлк Э. Крамер Глутаминовая кислота Glu 1866 Растительные белки Г. Риттхаузен Аспарагиновая кислота Asp 1868 Конглутин, легумин (ростки спаржи) Г. Риттхаузен Фенилаланин Phe 1881 Ростки люпина Э. Шульце, Й. Барбьери Аланин Ala 1888 Фиброин шелка Т. Вейль Лизин Lys 1889 Казеин Э. Дрексель Аргинин Arg 1895 Вещество рога С. Гедин Гистидин His 1896 Стурин, гистоны А. Кессель, С. Гедин Цистеин Cys 1899 Вещество рога К. Мёрнер Валин Val 1901 Казеин Э. Фишер Пролин Pro 1901 Казеин Э. Фишер Гидроксипролин 1902 Желатин Э. Фишер Триптофан Trp 1902 Казеин Ф. Гопкинс, Д. Кол Изолейцин Ile 1904 Фибрин Ф. Эрлих Метионин Met 1922 Казеин Д. Мёллер Треонин Thr 1925 Белки овса С. Шрайвер и др. Гидроксилизин 1925 Белки рыб С. Шрайвер и др. Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
Оптическая изомерия
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.
D-аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: так в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[2], что может быть использовано для определения возраста млекопитающих. Рацемизация остатков аспарагиновой также отмечена при старении коллагена, предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутремолекулярном ацилировании пептидного азота свободной карбоксильной группой аспарагиновой кислоты[3].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся не решённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20-ти протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Для запоминания однобуквенного обозначения протеиногенных аминокислот используется мнемоническое правило (последний столбец).
Глицин Gly G Glycine Гли Аланин Ala A Alanine Ала Валин Val V Valine Вал Изолейцин Ile I Isoleucine Иле Лейцин Leu L Leucine Лей Пролин Pro P Proline Про Серин Ser S Serine Сер Треонин Thr T Threonine Тре Цистеин Cys C Cysteine Цис Метионин Met M Methionine Мет Аспарагиновая кислота Asp D asparDic acid Асп Аспарагин Asn N asparagiNe Асн Глутаминовая кислота Glu E gluEtamic acid Глу Глутамин Gln Q Q-tamine Глн Лизин Lys K before L Лиз Аргинин Arg R aRginine Арг Гистидин His H Histidine Гис Фенилаланин Phe F Fenylalanine Фен Тирозин Tyr Y tYrosine Тир Триптофан Trp W tWo rings Три Классификация
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
- Полярные заряженные отрицательно при pH<7: аспартат, глутамат
- Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Заменимые
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями. По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы: глюкогенные (при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат), кетогенные (распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды), глюко-кетогенные (при распаде образуются метаболиты обоих типов).
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[4].
Примечания
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑ CLOOS P; FLEDELIUS C Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Архивировано из первоисточника 2 февраля 2012. Проверено 5 сентября 2011.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
См. также
- Аминокислотный фонд
- Кодон
- Пептидная связь
- Трансляция (биология)
Ссылки

Аминокислота в Викисловаре? - Аминокислоты // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Аминокислоты в химии
- Н. С. Энтелис Аминоацил-тРНК-синтетазы: два класса ферментов // Соросовский образовательный журнал, 1998, № 9, с. 14-21
- Эксперименты Миллера-Юри и обсуждения:
Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с. [1]
Основные группы биохимических молекулАминокислоты · Пептиды · Белки · Углеводы · Нуклеотиды · Нуклеиновая кислота · Липиды · Терпены · Каротиноиды · Стероиды · Флавоноиды · Алкалоиды · Гликозиды · Иридоиды
Аминокислоты Стандартные Нестандартные См. также Плазмозамещающие и перфузионные растворы — АТХ код:Препараты крови Плазмозамещающие препараты и белковые фракции плазмыАльбумин () • Фторкарбоновые кровезаменители () • Декстран () • Препараты желатина () • Гидроксиэтилкрахмал () • Гемоглобин глутамер (бычий) () Растворы для в/в введения Растворы для парентерального питанияАминокислоты () • Жировые эмульсии () • Углеводы () • Гидролизаты белков () • Комбинированные препараты для парентерального питания () Растворы, влияющие на водно-электролитный балансЭлектролиты () • Электролиты в сочетании с углеводами () • Трометамол () ОсмодиуретикиМаннитол () Ирригационные растворы Солевые растворыНатрия хлорид () • Натрия гидрокарбонат () Прочие ирригационные растворыДекстроза () Растворы для перитонеального диализа Изотонические растворыИкодекстрин () Гипертонические растворыНатрия хлорид () Добавки к растворам для в/в введения Электролитные растворыКалия хлорид () • Магния сульфат () • Кальция хлорид () • Кардиоплегические растворы () • Электролиты в комбинации с другими препаратами () АминокислотыАланилглутамин () Гемодиализаты и гемофильтраты Гемодиализаты (концентраты)Солкосерил () Категории:- Аминокислоты
- Цвиттер-ионы
Wikimedia Foundation. 2010.

