- Фосфоновые кислоты
-
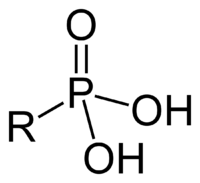
Фосфоновые кислоты — тип фосфорсодержащих органических соединений.Общая формула R-PO(OH)2. Есть связь «углерод-фосфор» Один из важнейших типов фосфоорганических соединений.
Содержание
Физические свойства
Гигроскопичные белые кристаллы, с четкими температурами плавления. В среднем-около 200С
В спектрах ЯМР 31P химически сдвиги для Фосфоновых кислот лежат в области 5-31 м д., полосы поглощения связи P = O в инфракрасных спектрах -в области 1150—1220 см −1.
Химические свойства
- образование солей с основаниями
Они бывают как кислыми, так и средними, в зависимости от количества объёмов основания и кислоты, так как фосфоновые кислоты двухосновны.
CH3-PO(OH)2+2NaOH=CH3-PO(ONa)2
CH3-PO(OH)2+NaOH=CH3-PO(OH)(ONa)
Получение
Получают реакцией PCl3 с водой и нитрилами
Применение
Используются в теплоэнергетике (их добавки ингибируют образование накипей и понижают жесткость воды), в нефте- и газодобыче, а также нефтепереработке (предотвращает гипсовые отложения в трубопроводах), в пищевой, парфюмерной и текстильной промышленности (добавки фосфоновых кислот ингибируют коррозию в автоклавах, входят в состав осветляющих композиций, стабилизируют вина и т. п.), при никелировании стали, как добавки к удобрениям), строительстве (замедлитель схватывания бетона и гипса). Являются основой для широкого класса боевых отравляющих веществ нервно-паралитического действия.
Важнейшие представители
- Фосфонуксусная кислота HOOCCH2P(O)(OH)2 — самая обычная фосфоновая кислота, не считая ее активности по отношению к вирусам.
- Нитрилометиленфосфоновая кислота — сильная шестиосновная кислота (pK1 0,3, рК2 1,5, рК3 4,64, рК4 5,88, рК5 7,3, рК6 12,1). С неорг. и орг. основаниями образует соли. Окисляется пероксидами в N-оксид. В широком интервале рН образует устойчивые комплексы с катионами металлов. Получают по схеме: NH3+3CH2O+PCl3+6H20=N[CH2P(O)(OH)2]3+9НCl. Слабо выражены токсические свойства, трудно окисляется, температура всп. 200 °C, температура самовоспламенение — около 440 °C, нижний предел взрываемости аэровзвеси 400 г/м³. ПДК в воздухе населенных пунктов 0,05 мг/л, для водоемов 0,6 мг/л; ЛД50 ок. 2000 мг/кг (для теплокровных, при приеме внутрь). Все области применения фосфоновых кислот для нее характерны
- Оксиэтилендендифосфорная кислота СН3С(ОН)[Р(О)(ОН)
Сильная пятиосновная к-та: рКа 1,7, 2,47, 7,28, 10,29 и 11,13. Разлагается при температуре около 250 °C (в водных р-рах разлагается при 140 °C); с основаниями образует соли. Избытком уксусного ангидрида ацетилируется по группе СОН; при обработке диазаалканами образует тетраэфиры. При нагр. претерпевают фосфонат-фосфатную перегруппировку.
т. пл. 198—200 °С; 350 кДж/кг, −1214 кДж/моль, −2177 кДж/моль. Растворимость (г/л): в воде-2300, в этаноле-700, ДМФА-125, ДМСО-200, 30%-ной уксусной к-те-1500; не раств. в ацетоне, углеводородах и алкилгалогенидах. В спектре ЯМР 31Р хим. сдвиг 19,3 м.д. (относительно 85%-ной Н3РО4); в спектре ПМР химический сдвиг 1,35 м.д. (СН3). Константа спин-спинового взаимод. для НССР 16 Гц.
Синтезируется из хлорида фосфора, воды и уксусной кислоты Используется в нефтедобывающей промышленности и теплоэнергетике (ее добавки предотвращают отложение солей в котлах и трубопроводах), в сельском хозяйстве (регулятор роста зерновых и зернобобовых), в парфюмерии и косметике (стабилизатор изделий), в бытовой химии (входит в состав препаратов для отбеливания, удаления накипи и пятен)
Хорошо горит, температура самовоспломенения 220 °C (аэрогель) и 338 °C (аэрозоль)
См. также
Ссылки
- Лит.: Нифантьев Э. Е., Химия фосфорорганических соединений
- xumuk.ru
- chem.isu.ru

Для улучшения этой статьи желательно?: - Викифицировать статью.
- Исправить статью согласно стилистическим правилам Википедии.
Категории:- Кислоты
- Фосфорорганические соединения
Wikimedia Foundation. 2010.