- Триптофан
-
Триптофан 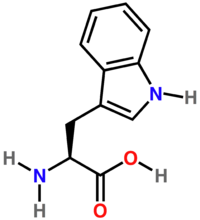
Общие Систематическое наименование 2-амино-3-(1H-индол-3-ил)пропионовая кислота Сокращения Три, Trp, W
UGGХимическая формула ? Эмпирическая формула C11H12N2O2 Физические свойства Молярная масса 204,23 г/моль Термические свойства Классификация Рег. номер CAS 73-22-3 SMILES N[C@@H](Cc1c2ccccc2n([H])c1)C(O)=O Триптофа́н — (β-индолиламинопропионовая, или α-2-амино-3-(1H-индол-3-ил)пропионовая кислота, сокр.: Три, Трп, Trp, W) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах — L и D и в виде рацемата (DL).
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
Биосинтез
Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Биосинтез антранилата рассмотрен в статье шикиматный путь. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата имеют название trp-гены и у бактерий объединены в триптофановый оперон.
Схематично строение триптофанового оперона Escherichia coli можно выразить записью:
—trpR—…—Промотор—Оператор—Лидер—Аттенуатор—trpE—trpD—trpC—trpB—trpA—Терминатор—Терминатор—
Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В рекции высвобождается неорганический пирофосфат. У Escherichia coli реакцию осуществляет компонент II антранилат-синтазы, продукт гена trpD.
- Фосфорибозилантранилат изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, роисходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB).[1]
В природе триптофан синтезируют микроорганизмы, растения и грибы. Многоклеточные животные не способны синтезировать триптофан de novo. Для человека, как и для всех Metazoa, триптофан является незаменимой аминокислотой и должен поступать в организм в достаточном количестве с белками пищи.
Катаболизм
Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его.Катаболические превращения L-триптофана в организме человека:
Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат
N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат
Кинуренин→антранилат→3-гидроксиантранилат
3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3-гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
Метаболиты
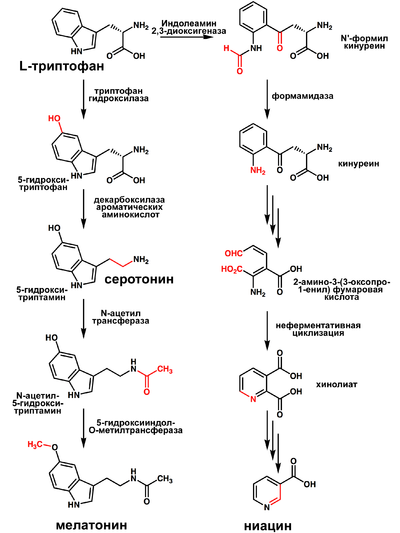
Триптофан является биологическим прекурсором серотонина (из которого затем может синтезироваться мелатонин) и ниацина (см. рисунок).
Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана.
Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии[2] и депрессии, но клинические испытания не дали окончательных результатов[3]. 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин или 5-HT)[4].
В связи с преобразованием 5-HTP в серотонин в печени, есть значительный риск появления пороков сердца от влияния серотонина на сердце[5][6].
Способы получения и производство триптофана
Химический синтез
Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометил-индол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D/L-триптофан обычно в форме натриевой соли.[7] В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений. Синтетический триптофан добавляют в комбикорма для животных.
Химико-ферментативный синтез
У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода ⇋ индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез
В промышленном производстве L-триптофана обычно используются штаммы дрожжей Candida utilis, дефектные по aro-генам и, как следствие, ауксотрофные по фенилаланину и тирозину. Исходным сырьём обычно служит относительно дешёвая синтетическая антраниловая кислота, что является целесообразным по нескольким причинам. Во-первых, это упрощает и удешевляет процесс, а во-вторых, позволяет обойти механизмы регуляторного контроля (целевой продукт триптофан оказывает ингибирующее действие на антранилатсинтазу). В присутствии минимальных, не вызывающих регуляторных эффектов, количеств фенилаланина и тирозина мутанты Candida utilis переводит вводимую в культуральную среду антраниловую кислоту в L-триптофан.
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Пищевые источники триптофана
Триптофан является компонентом пищевых белков. Наиболее богаты триптофаном такие продукты, как грибы, овёс, бананы, сушёные финики, арахис, кунжут, кедровый орех, молоко, йогурт, творог.
Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Одним из лучших источников триптофана является арахис, причем как цельные орехи, так и арахисовое масло.
Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан[8].
Таблица содержания триптофана в продуктах
№ п/п продукт в мг на 100 г 1 Горох, фасоль 260 2 Мука пшеничная (1-й сорт) 120 3 Крупа гречневая 180 4 Рис 80 5 Пшено 180 6 Крупа овсяная 160 7 Крупа перловая 100 8 Хлеб ржаной 70 9 Хлеб пшеничный 100 10 Макаронные изделия 130 11 Молоко, кефир 40 12 Творог нежирный 180 13 Творог жирный 210 14 Сыр голландский 790 15 Сыр плавленый 500 16 Говядина I категории 210 17 Говядина II категории 230 18 Баранина, свинина мясная 200 19 Мясо кролика 330 20 Колбаса молочная 160 21 Куры I категории 290 22 Яйца куриные 200 23 Карп 180 24 Окунь морской 170 25 Палтус, судак 180 26 Сельдь 250 27 Скумбрия 160 28 Ставрида 300 29 Треска 210 30 Паста «Океан» 220 31 Капуста белокочанная 10 32 Картофель 30 33 Морковь 10 34 Свекла 10 Нарушения обмена
Семейная гипертриптофанемия
Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнапа
Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада
Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса
Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия
Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии
В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии-миалгии. Огласке эта проблема подверглась в 1989, после того, как личные врачи трёх американок, обсудив между собой ситуацию, забили тревогу. В настоящее время масштаб той вспышки оценивают в 60000 случаев, из которых около 1500 случаев закончились инвалидизацией, не менее 27 закончились смертельным исходом. Было установлено, что заболевших связывало то, что практически все они принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах было выявлено более 60 различных примесей. Эти примеси, среди которых особенно подозрительными были EBT (1,1'-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни для одной из них не была установлена способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии. Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты рассматривали возможность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан. Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привели к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали примеру. В феврале 2001 FDA ослабил ограничения, но все ещё выразил следующее беспокойство:
- «Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.»
Перевод:
- «Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными, факторами.»
Триптофан и иммунная система
Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для инфицированных вирусом или раковых клеток.
Триптофан и продолжительность жизни
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте.
Триптофан и сонливость
Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Флуоресценция
Триптофан обладает наиболее сильной флуоресценцией среди всех 20-ти протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Аналоги триптофана
Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Применение
Триптофан применяется для сбалансирования кормов для животных. Препараты L-триптофана назначаются при расстройстве сна, чувстве страха и напряжения, дисфории, предменструальном синдроме. Показаниями к применению также являются: комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом, лечения маниакальной депрессии и депрессии, связанной с менопаузой. Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90 %.
Примечания
- ↑ Бокуть С. Б. и соавт. — «Молекулярная биология: молекулярные механизмы хранения, воспроизведения и реализации генетической информации»; Минск, «Вышэйшая школа», 2005 г. — ISBN 985-06-1045-X
- ↑ Kostowski W, Bidzinski A, Hauptmann M, Malinowski JE, Jerlicz M, Dymecki J (1978). «Brain serotonin and epileptic seizures in mice: a pharmacological and biochemical study». Pol J Pharmacol Pharm 30 (1): 41–7. PMID 148040. (англ.)
- ↑ Turner EH, Loftis JM, Blackwell AD (2006). «Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan». Pharmacol Ther 109 (3): 325–38. DOI:10.1016/j.pharmthera.2005.06.004. PMID 16023217. (англ.)
- ↑ Hardebo JE, Owman C (1980). «Barrier mechanisms for neurotransmitter monoamines and their precursors at the blood-brain interface». Ann NeurolAnn Neurol 8 (1): 1–31. DOI:10.1002/ana.410080102. PMID 6105837. (англ.)
- ↑ Gustafsson BI, Tømmerås K, Nordrum I, Loennechen JP, Brunsvik A, Solligård E, Fossmark R, Bakke I, Syversen U, Waldum H (March 2005). «Long-term serotonin administration induces heart valve disease in rats». Circulation 111 (12): 1517–22. DOI:10.1161/01.CIR.0000159356.42064.48. PMID 15781732. (англ.)
- ↑ Xu J, Jian B, Chu R, Lu Z, Li Q, Dunlop J, Rosenzweig-Lipson S, McGonigle P, Levy RJ, Liang B (December 2002). «Serotonin mechanisms in heart valve disease II: the 5-HT2 receptor and its signaling pathway in aortic valve interstitial cells». Am. J. Pathol. 161 (6): 2209–18. DOI:10.1016/S0002-9440(10)64497-5. PMID 12466135. (англ.)
- ↑ Солдатенков А. Т., Колядина Н. М., Шендрик И. В. — «Основы органической химии лекарственных веществ»; Москва, «Химия», 2001 г.
- ↑ Белки — основа полноценного питания
- ↑ Химический состав пищевых продуктов. / Под ред. М. Ф. Нестерина и И. М. Скурихина.
Для улучшения этой статьи желательно?: - Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Аминокислоты Стандартные Нестандартные См. также Категории:- Аминокислоты
- Производные индола
Wikimedia Foundation. 2010.