- Алкины
-
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
 3D модель ацетилена — простейшего алкина
3D модель ацетилена — простейшего алкина
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
История открытия
Впервые ацетилен был получен в 1836 году Эдмундом Дэви, двоюродным братом знаменитого английского химика Гемфри Дэви, нагреванием уксуснокислого калия с древесным углем и последующей реакцией с водой образовавшегося карбида калия [1]. Дэви назвал свой газ «двууглеродистым водородом».
В 1862 году немецкий химик и врач Ф. Вёлер вновь открыл ацетилен, действуя водой на карбид кальция.
В 1863 году французский химик М. Бертло получил ацетилен, пропуская водород над раскаленными электрической дугой графитовыми электродами[2]. Именно он дал газу имя ацетилен (от латинских слов acetum — уксус и греческого иле — дерево). Русское название «ацетилен» впервые было применено Д. И. Менделеевым[3].
Большую роль в изучении химии ацетилена и его производных в конце XIX века сыграл А. Е. Фаворский.
В 1895 году Ле Шателье обнаружил, что ацетилен, сгорая в кислороде, дает очень горячее пламя, что впоследствии легло в основу ацетиленовой технологии сварки и резки тугоплавких металлов[4].
Номенклатура алкинов
Простейшим алкином является этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Ниже представлены некоторые представители алкинов и их названия:
Различают внутреннюю тройную связь (пример: бут-2-ин) и концевую (пример: бут-1-ин).
Гомологический ряд алкинов:
- Этин: C2H2
- Пропин: C3H4
- Бутин: C4H6
- Пентин: C5H8
- Гексин: C6H10
- Гептин: C7H12
- Октин: C8H14
- Нонин: C9H16
- Децин: C10H18
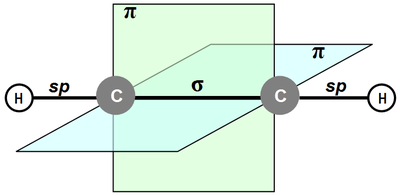
Структура тройной связи
У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях[5]. Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.
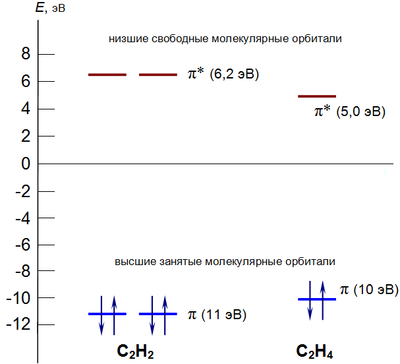
На представленной выше диаграмме приведены молекулярные орбитали этилена и ацетилена.
Физические свойства
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
Физические свойства некоторых алкинов[6][7] № Название Формула Т плавления,°С Т кипения,°С Плотность, d204 1 Этин С2H2 −81,8 −75 0,565* 2 Пропин C3H4 −101,5 −23 0,670* 3 Бут-1-ин HC≡C−CH2CH3 −125,9 8,1 0,678* 4 Бут-2-ин CH3−C≡C−CH3 −32,3 27,0 0,694 5 Пент-1-ин HC≡C−C3H7 −90,0 39,3 0,695 6 Пент-2-ин CH3−C≡C−C2H5 −101,0 55,0 0,714 7 3-Метилбут-1-ин HC≡C−CH(CH3)CH3 н/д 28,0 0,665 8 Гекс-1-ин HC≡C−C4H9 −132,4 71,4 0,719 * Значения измерены при температуре кипения.
Нахождение в природе и физиологическая роль алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения содержащие полиацетиленовые структуры[8].
Ацетилен обнаружен в атмосфере Урана[9], Юпитера[10] и Сатурна[11].
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги[12].
Методы получения
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:

При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:

Пиролиз углеводородов (промышленный способ)
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана[13]:

Крекинг природного газа (промышленный способ)
Электрокрекинг
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением[14].
Термоокислительный крекинг
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании[14]:

Метод прямого синтеза
Углерод напрямую взаимодействует с водородом при очень высоких температурах:

Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертло).
Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия[15]:

Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)
Реакция дегидрогалогенирования проводят действием сильного основания на дигалогеналканы:

В качестве дегидрогалогенирующего агента удобно использовать амид натрия в жидком аммиаке [16]:

Алкилирование алкинов (лабораторный способ)
Алкилирование алкинов с концевой тройной связью производится по следующей схеме:

Подробнее смотри подраздел: Реакции нуклеофильного замещения алкинидов.
Прочие лабораторные способы получения алкинов
- Реакция Кори-Фукса — синтез алкинов из альдегидов[17]:
На первой стадии идет образование дибромалкена:

На второй стадии происходит отщепление брома:

- Разложение дигидразонов[18]:

- Перегруппировка Фрича-Буттенберга-Вихелля — превращение 1,1-диарил-2-дигалогенэтиленов в производные ацетилена под действием сильных оснований[19]:
Химические свойства
Кислотные свойства алкинов и реакции нуклеофильного замещения
Образование алкинидов
Алкины с концевой тройной связью являются С-H кислотами (сильнее чем аммиак и алкены, но слабее, чем спирты) которые с очень сильными основаниями могут образовывать соли — алкиниды[6]:
 (ацетиленид динатрия)
(ацетиленид динатрия) (ацетиленид калия)
(ацетиленид калия) (пропинилмагнийбромид)
(пропинилмагнийбромид)Реакция алкинов с аммиакатами серебра или одновалентной меди является качественной на наличие концевой тройной связи[6]:



Пропинид серебра представляет собой осадок белого цвета, пропинид меди - осадок жёлтого цвета, наконец, диацетиленид меди - осадок красного цвета.
Алкинид серебра легко растворяется при добавлении цианида натрия с выделением соответствующего алкина[8]:
![\mbox{CH}_3\!\!-\!\!\mbox{C}\!\!\equiv\!\!\mbox{C}\!\!-\!\!\mbox{Ag}+2\mbox{NaCN}+\mbox{H}_2\mbox{O}\rightarrow\mbox{CH}_3\!\!-\!\!\mbox{C}\!\!\equiv\!\!\mbox{CH}\!\uparrow+\mbox{Na}[\mbox{Ag(CN)}_2]+\mbox{NaOH}](bb073d66721afff671540c66ee870d3e.png)
Смотри также статью: Ацетилениды.
Реакции электрофильного замещения алкинидов
Алкиниды являются сильными нуклеофилами и легко вступают в реакции нуклеофильного замещения:

Это, в частности, широко используется для синтеза гомологов ацетилена:

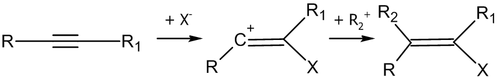
Получение алкингалогенидов
Действием галогена на монозамещенные ацетилены в щелочной среде можно получить галогеналкины[14]:

Реакция нуклеофильного замещения алкинидов

В препаративном синтезе часто используют комплекс ацетиленида лития с этилендиамином как удобный источник ацетиленид-аниона[8].
Следует отметить, что в случае реакции с вторичными или третичными галогеналканами реакция во многом идет по альтернативному пути (элиминирование):

Прочие реакции
Хлорированием ацетилена хлоридом меди (II) в водных растворах CuCl можно получить дихлорацетилен[20]:

Ацетиленовая конденсация
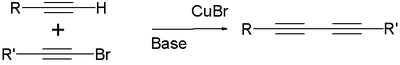
Ацетиленовая конденсация или иначе реакция Ходкевича-Кадио, заключается во взаимодействии ацетиленовых углеводородов с бром- или йодалкинами с образованием диацетиленов[21]:
Аналогично протекает и реакция Куртца (катализатор — ацетиленид меди):

Получение ацетиленаминов

Реакция идет в присутствии солей меди (I).
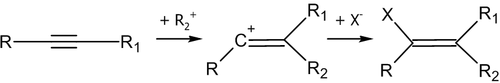
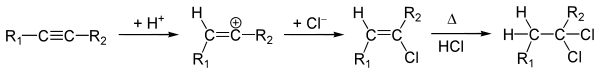
Реакции электрофильного присоединения
Электрофильное присоединение к алкинам инициируется под воздействием положительно заряженной частицы — электрофила. В общем случае, катализатором таких реакций являются кислоты.
Общая схема первой стадии реакции электрофильного присоединения:
Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:


Галогенирование алкинов идет как транс-присоединение (как правило) и протекает по аналогии с галогенированием алкенов.
Вместе с тем, присоединение по тройной связи идет труднее, чем по двойной, в связи с чем при наличии в соединении как двойной, так и тройной связи, возможно провести избирательное присоединение:
Смотри также статью: Алкены, подраздел «Галогенирование».
Реакции гидрогалогенирования
Присоединение хлороводорода и бромоводорода к алкинам происходит по аналогии с алкенами. Реакция идет в две стадии: сперва образуется галогеналкен, который далее переходит в дигалогеналкан:
Несмотря на бо́льшую электроотрицательность галогенов, обе стадии реакции идут по правилу Марковникова. Это объясняется возникновением p-сопряжения между атомами галогена и водорода. Как видно из схемы, в результате реакции присоединения образуются транс- изомеры.
Смотри также статью: Алкены, подраздел «Гидрогалогенирование».
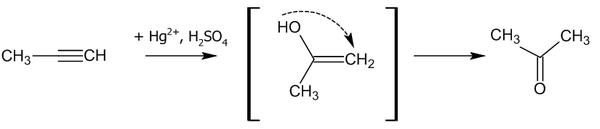
Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов). Эта реакция известна как реакция Кучерова.
Считается, что процесс гидратации идет через стадию образования енола:
Реакции карбонилирования
Реакция карбонилирования были открыты в лаборатории Реппе в 1939 году[20].

где Х: ОН, OR, OCOR, NH2 и пр.


Катализатором реакции являются карбонилы никеля или палладия[22].
Отдельно стоит упомянуть реакцию оксилительного карбохлорирования:

Прочие реакции электрофильного присоединения
- Присоединение карбоновых кислот с образованием диэфиров:

Уксусная кислота в реакции с ацетиленом образует винилацетат:

Ацетиленовые углеводороды присоединяют CO2 и вторичные амины с образованием амидов:

- Реакция ацетилена с цианистым водородом в присутствии солей одновалентной меди с получением акрилонитрила:

- Ацетилен способен в присутствии катализаторов присоединять углеводороды с образованием новых С-С связей[20]:

или

Реакции нуклеофильного присоединения
Нуклеофильное присоединение к алкинам инициируется под воздействием отрицательно заряженной частицы — нуклеофила. В общем случае, катализатором таких реакций являются основания. Общая схема первой стадии реакции нуклеофильного присоединения:
Типовые реакции нуклеофильного присоединения
- Характерным примером реакции нуклеофильного присоединения является Реакция Фаворского — присоединение спиртов в присутствии щелочей с образованием алкенильных эфиров:


По аналогии ацетилен реагирует с аммиаком, образуя этилиденимин[20]:

При высокой температуре в присутствии катализатора имин дегидрируется и превращается в ацетонитрил:

- В среде очень сильных оснований (например: КОН+ДМСО) ацетилен реагирует с сероводородом, образуя дивинилсульфид[20]:

Реакции радикального присоединения
В присутствии перекисей или других условиях, способствующих образованию свободных радикалов, присоединение к алкинам идет по радикальному механизму — против правила Марковникова (эффект Хараша):

По свободнорадикальному механизму* может протекать реакция алкинов с тиолами:

* — В присутствии оснований реакция идет по нуклеофильному механизму.
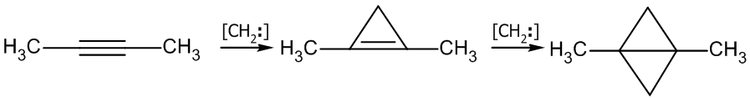
Аналогично происходит присоединение карбенов:
Смотри также статью: Алкены, подраздел «Реакции радикального присоединения».
Реакции этинилирования
Реакциями этинилирования называют реакции увеличения углеродного скелета алкинов с сохранением тройной связи. Они могут протекать как по электрофильному, так и нуклеофильному механизму в зависимости от среды и условий реакции, характера субстрата, а также типа используемого катализатора.
Получение ацетиленовых спиртов
В присутствии сильных оснований алкины с концевой тройной связью способны присоединять карбонильные соединения с образованием спиртов[14] (Реакция Фаворского):

Важнейшей реакцией из этой группы является присоединения формальдегида к ацетилену с образованием пропаргилового спирта и далее бутин-2-диола-1,4*:


* Бутин-2-диол-1,4 является важным промежуточным полупродуктом для получения бутиленгликоля, γ-Бутиролактона, изопрена и тетрагидрофурана.
Эту реакцию разработал в 1925 году Реппе (Реакция Фаворского-Реппе). Она протекает при высоком давлении в присутствии ацетиленида меди.
Смотри также статью: Именные реакции в органической химии, подраздел «Реакция Фаворского-Реппе».
Получение ацетиленовых эфиров и кислот
Ацетиленовые кислоты или их эфиры можно получить по реакции Цужи[20]:

Катализаторы: PdCl2, CuCl.
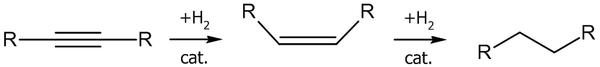
Реакции гидрирования
Гетерогенное гидрирование
Гидрирование алкинов водородом на гетерогенных катализаторах, как правило, приводит к образованию цис-присоединения[6]. Катализаторами гидрирования служат Ni, Pd, Pt, а также оксиды или комплексы Ir, Ru, Rh и некоторых других металлов.
На первой стадии образуется алкен, который практически сразу же гидрируется до алкана:
Для остановки реакции на стадии получения алкена используют катализаторы Линдлара (Pd/PbO/CaCO3) или борид никеля.
При гидрировании ацетилена на никель-кобальтовом катализаторе можно получить изобутилен:

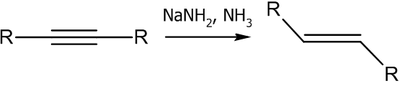
Гомогенное гидрирование
Гомогенное гидрирование проводят в амидом натрия в жидком аммиаке или алюмогидридом лития в тетрагидрофуране. В ходе реакции образуются транс-алкены.
Гидроборирование
Алкины легко присоединяют диборан против правила Марковникова, образуя цис-алкенилбораны:

Реакция интересна тем, что далее алкенилбораны легко перевести в соответствующие цис-алкены простым действием уксусной кислоты[18]:

или окислить H2O2 до альдегида или кетона[18]:

Восстановительное карбоксилирование
По аналогии с реакциями алкенов, алкины вступают в реакцию восстановительного карбоксилирования. В зависимости от условий реакции и типов катализаторов, конечными продуктами могут стать спирты, альдегиды или алканы:


Смотри также статью: Алкены, подраздел «Реакции карбонилирования».
Реакции окисления
Реакции окислительного присоединения
Алкины окисляются более трудно чем алкены, однако при контролируемом окислении можно сохранить C-C связь и получить в качестве продуктов реакции карбонильные соединения[16]:
![\mbox{RC}\!\!\equiv\!\!\mbox{CR}+2[\mbox{O}]\rightarrow\mbox{R}\!\!-\!\!\mbox{C}(\mbox{O})\!\!-\!\!\mbox{C}(\mbox{O})\!\!-\!\!\mbox{R}](493d7d65ec3059407832e220cb4e625e.png)
В качестве окислителя может выступать озон (с последующим восстановлением и гидролизом озонида), KMnO4 в слабощелочной или нейтральной среде и некоторые другие вещества[16].
Ацетилен, в зависимости от окислителя может давать три продукта:
![\mbox{HC}\!\!\equiv\!\!\mbox{CH}+2[\mbox{O}]\rightarrow\mbox{CHO}\!\!-\!\!\mbox{CHO}](e8feee1e3d211c8ac3c790b7536bc92f.png) (глиоксаль) — окисление разбавленной HNO3 в присутствии PdCl2 и NaNO2[20].
(глиоксаль) — окисление разбавленной HNO3 в присутствии PdCl2 и NaNO2[20].![\mbox{HC}\!\!\equiv\!\!\mbox{CH}+3[\mbox{O}]\rightarrow\mbox{CHO}\!\!-\!\!\mbox{COOH}](982d8f3ee6115362611e763d0b47b6ee.png) (глиоксалевая кислота) — окисление KClO3 в субстрате вода+диэтиловый эфир[16].
(глиоксалевая кислота) — окисление KClO3 в субстрате вода+диэтиловый эфир[16].![\mbox{HC}\!\!\equiv\!\!\mbox{CH}+4[\mbox{O}]\rightarrow\mbox{HOOC}\!\!-\!\!\mbox{COOH}](83a9bb70c66c9020155312b4aa86e09d.png) (щавелевая кислота) — окисление KMnO4 в кислой среде или HNO3 в присутствии PdCl2.
(щавелевая кислота) — окисление KMnO4 в кислой среде или HNO3 в присутствии PdCl2.Отдельный тип реакций — реакции оксилительного карбоксилирования.
В растворах комплексов палладия образуются эфиры малеиновой кислоты:

Реакции окислительного расщепления
При действии сильных окислителей в жестких условиях алкины окисляются с разрывом тройной связи. В ходе реакции образуются карбоновые кислоты и CO2:
![\mbox{RC}\!\!\equiv\!\!\mbox{CR}'+3[\mbox{O}]+\mbox{H}_2\mbox{O}\rightarrow\mbox{RCOOH}+\mbox{R}'\mbox{COOH}](d9872a487ddc3f9a63667660fca1f7f6.png)
![\mbox{RC}\!\!\equiv\!\!\mbox{CH}+4[\mbox{O}]\rightarrow\mbox{RCOOH}+\mbox{CO}_2](44afd309316f55cf408c6ca3e9274fc4.png)
Реакции оксилительного сочетания
В присутствии солей одновалентной меди в спиртовом растворе аммиака алкины окисляются кислородом воздуха до диацетиленов (Реакция Глазера):

Реакция для ацетилена может идти c образованием полиинов:

Эта реакция легла в основу синтеза карбина[24].
Реакции изомеризации
В 1887 году А.Е Фаворским была открыта изомеризация алкинов под действием сильных оснований (нуклеофильная атака)[6]. Эта реакция носит название Реакция Фаворского или ацетилен-алленовой перегруппировки:
![\mbox{CH}_3\!\!-\!\!\mbox{CH}_2\!\!-\!\!\mbox{C}\!\!\equiv\!\!\mbox{CH}\rightleftarrows[\mbox{CH}_3\!\!-\!\!\mbox{CH}\!\!=\!\!\mbox{C}\!\!=\!\!\mbox{CH}_2]\rightleftarrows\mbox{CH}_3\!\!-\!\!\mbox{C}\!\!\equiv\!\!\mbox{C}\!\!-\!\!\mbox{CH}_3](51e94a9f9fffb5b30344923cccdeb6c3.png)
Реакции олигомеризации, полимеризации и циклообразования
Реакции олигомеризации
В присутствии солей меди(I) и хлорида аммония в водной среде ацетилен вступает в реакцию олигомеризации с образованием винилацетилена:

Реакция может идти дальше с образованием дивинилацетилена:

Реакция была впервые открыта Ю. Ньюлендом и служит первой промышленной стадией для синтеза хлоропрена.
Реакции полимеризации
Впервые полимеризацию ацетилена осуществил Дж. Натта в 1957 году, пропуская газ над раствором катализатора Al(C2H5)3-Ti(OC4H9)4[25]:

В ходе реакции был получен полукристаллический полиацетилен.
Полиацетилен интересен тем, что введением в него определенных добавок (допирование) можно получить электропроводящий полимер с металлическими свойствами[25].
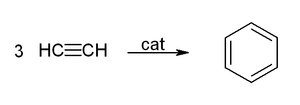
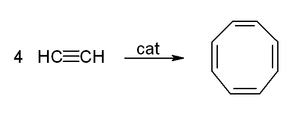
Реакции циклобразования
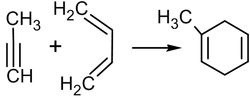
Ацетилен под действием катализаторов — раскалённого активированного угля при 500 °С (реакция Бертло) или органоникелевого катализатора (например, тетракарбонила никеля) при 60 °С и повышенном давлении (реакция Реппе) — достаточно легко циклотримеризуется, образуя бензол, а в других условиях (катализатор — цианид никеля(II) в ТГФ) — циклооктатетраен:
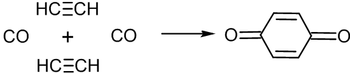
Циклообразование в присутствии оксида углерода(II) приводит к получению бензохинона[13]:
Важной способностью алкинов является их возможность вступать в реакцию Дильса-Альдера:
Реакции образования гетероциклов
Образование производных пиррола
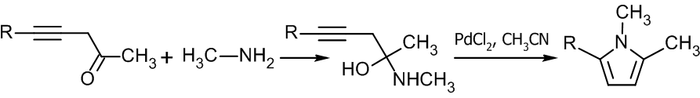
Взаимодействие ацетилена с оксимами кетонов в присутствии супероснования приводит к получению пиррольного кольца (Реакция Трофимова)[26]:
Гетероциклизация протекает при температуре 70—120 °С в среде диметилсульфоксида.
Существуют и альтернативные варианты синтеза[27]:
Образование производных фурана
При обработке алкинов водяным паром и CO в присутствии родиевого катализатора при давлении 10 МПа и 100 °C образуются производные фурана[28]:
Образование прочих гетероциклов
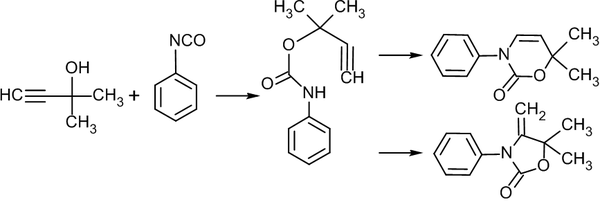
Приведем ещё несколько примеров образования гетероциклов с использованием алкинов[29][30]:
Идентификация алкинов
Качественной реакцией на алкины с концевой тройной связью является взаимодействие с аммиакатом серебра или меди (подробнее смотри подраздел: Образование алкинидов).
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии. ИК спектры асимметричных алкинов имеют характеристические полосы при 2260—2100 см−1 (валентные колебания тройной связи), 3310-3300 см−1 (колебания С-Н связей) и деформационные колебания C-H при 700—610 см−1[13].
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём.
Ацетилен использует для синтеза следующих продуктов:
- тетрахлорэтан, трихлорэтилен, дихлорэтилен (хлорирование ацетилена) — растворители;
- акрилонитрил (конденсация ацетилена с циановодородом) — для получения полиакрилонитрила;
- акриламид (конденсация ацетилена с CO и аммиаком) — для получения полиакриламида;
- тетрагидрофуран (конденсация ацетилена с формальдегидом с последующим гидрированием и дегидратацией) — важный растворитель, сырье для уретановых полимеров;
- винилхлорид (гидрохлорирование ацетилена) — для получения поливинилхлорида;
- винилацетат (конденсация с уксусной кислотой) — для получения поливинилацетата;
- ацетальдегид (гидратация ацетилена) — для дальнейшего получения уксусной кислоты, ацетона и др. продуктов;
- бутиленгликоль (конденсация ацетилена с формальдегидом с последующим гидрированием) — для получения полиуретанов, полиэфиров, пластификаторов.
- винилацетилен (димеризация ацетилена) — полупродукт для синтеза полимеров;
- хлоропрен (гидрохлорирование винилацетилена) — для получения хлоропреновых каучуков;
- бутадиен (дегидратация бутиленгликоля) — для получения бутадиеновых каучуков;
При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена)[13].
В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники (источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту[31]. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение[32].
См. также

Алкины в Викисловаре? 
Алкины на Викискладе? Примечания
- ↑ Ацетилен. Он-лайн энциклопедия "Кругосвет". Архивировано из первоисточника 23 августа 2011. Проверено 22 июля 2009.
- ↑ Соловьев Ю. И. История химии: Развитие химии с древнейших времен до конца XIX в. Пособие для учителей. — 2-е изд., перераб. — М.: Просвещение, 1983. — С. 208.
- ↑ Химические термины: ацетилен. Chemfiles.narod.ru. Архивировано из первоисточника 23 августа 2011. Проверено 22 июля 2009.
- ↑ Статьи о газах: ацетилен. Компания «НИИ КМ». Архивировано из первоисточника 23 августа 2011. Проверено 22 июля 2009.
- ↑ Строение тройной связи C≡C (раздел 6.1.). Интерактивный мультимедиа учебник "Органическая химия". Самарский ГУ, Кафедра органической, биорганической и медицинской химии. Архивировано из первоисточника 23 августа 2011. Проверено 22 июля 2009.
- ↑ 1 2 3 4 5 Травень В.Ф. Органическая химия: Учебник для вузов: В 2 т / В.Ф.Травень. — ИКЦ «Академкнига», 2004. — Т. 1. — 727 с. — ISBN 5-94628-171-2
- ↑ Физические свойства алкинов. Обучающие энциклопедии. Химия. Архивировано из первоисточника 23 августа 2011. Проверено 22 июля 2009.
- ↑ 1 2 3 Терней А.Л. Современная органическая химия. — М.: Мир, 1981. — Т. 1. — С. 355-375.
- ↑ Уран: к полюсу вращения. Междисциплинарный научный сервер. Архивировано из первоисточника 23 августа 2011. Проверено 20 июля 2009.
- ↑ Бронштэн В.А. Планеты и их наблюдение. Параграф №16. Юпитер, Сатурн, Уран и Нептун. Книги по астрономии и телескопостроению. Астрономия и телескопостроение. Архивировано из первоисточника 23 августа 2011. Проверено 20 июля 2009.
- ↑ Планеты солнечной системы. Сатурн. Астрономическая энциклопедия. Астрономический сайт "Галактика". Проверено 22 июля 2009.
- ↑ Вредные вещества. Непредельные углеводороды ацетиленового ряда. Новый справочник химика и технолога. Chemanalytica.com. Архивировано из первоисточника 22 августа 2011. Проверено 22 июля 2009.
- ↑ 1 2 3 4 Ацетилен // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 428-431.
- ↑ 1 2 3 4 Нейланд О. Я. Органическая химия: Учеб. для хим. вузов. — М.: «Высшая школа», 1990. — 750 с. — ISBN 5-06-001471-1
- ↑ Щелкунов А. В., Васильева Р. Л., Кричевский Л. А. Органическая химия: Учеб. для хим. вузов. — Алма-Ата: «Наука», 1976. — С. 31-32.
- ↑ 1 2 3 4 Хейнс А. Методы окисления органических соединений: Алканы, алкены, алкины и арены = Methods for the oxidation of organic compounds: Alkanes, Alkenes, Alkynes and Arenes / Перевод с англ., под редакцией И.П.Белецкой. — М.: Мир, 1988. — 400 с. — ISBN 5-03-000149-2
- ↑ Corey-Fuchs Reaction (англ.). Name Reactions. Organic Chemistry Portal. Архивировано из первоисточника 23 августа 2011. Проверено 22 июля 2009.
- ↑ 1 2 3 Марч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4-х томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под редакцией И.П.Белецкой. — М.: Мир, 1988. — Т. 4. — 468 с.
- ↑ Ли Дж. Именные реакции. Механизмы органических реакций = Name reactions / Пер. с англ. В.М.Демьянович. — М.: БИНОМ. Лаборатория знаний, 2006. — 363 с. — ISBN 5-94774-368-X
- ↑ 1 2 3 4 5 6 7 Темкин О. Н. Химия ацетилена. «Ацетиленовое дерево» в органической химии XXI века. / Соросовский образовательный журнал, том 7, № 6, 2001 год
- ↑ Кадио-Ходкевича реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 2. — С. 550-551.
- ↑ Темкин О. Н., Шестаков Г. К., Трегер Ю.А. Ацетилен: Химия. Механизмы реакций. Технология. — М.: «Химия», 1991. — 416 с. — ISBN ISBN 5-7245-0574-6
- ↑ Марч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4-х томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под редакцией И.П.Белецкой. — М.: Мир, 1988. — Т. 3. — 173-174 с.
- ↑ Сладков А. М. Карбин — третья аллотропная форма углерода: Монография / под ред. Бубнова Ю. Н.. — М.: Наука, 2003. — ISBN 5-02-002822-3
- ↑ 1 2 Полиацетилен // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 3. — С. 1215-1216.
- ↑ Трофимов Б. А. Гетероатомные производные ацетилена. Новые полифункциональные мономеры, реагенты и полупродукты. — М.: Наука, 1981. — 319 с.
- ↑ Визер С. А., Ержанов К. Б. Синтез гетероциклов каталитической внутримолекулярной циклизацией ацетиленовых соединений // Избранные методы синтеза и модификации гетероциклов : Сборник / Под редакцией В. Г. Карцева. — М.: IBS PRESS, 2003. — Т. 2. — С. 95-96. — ISBN 5-93584-009-Х.
- ↑ Визер С. А. Образование гетероциклов при каталитическом карбонилировании ацетиленовых соединений // Избранные методы синтеза и модификации гетероциклов : Сборник / Под редакцией В. Г. Карцева. — М.: IBS PRESS, 2003. — Т. 2. — С. 63-64. — ISBN 5-93584-009-Х.
- ↑ Великородов А. В. Карбаматы и их производные в синтезе азотсодержащих гетероциклов // Избранные методы синтеза и модификации гетероциклов : Сборник / Под редакцией В. Г. Карцева. — М.: IBS PRESS, 2003. — Т. 2. — С. 37. — ISBN 5-93584-009-Х.
- ↑ Родиновская Л. А., Чунихин К. С., Шестопалов А. М. α-Нитрокарбонильные соединения, их производные и α,β-непредельные нитросоединения в синтезе гетероциклов // Избранные методы синтеза и модификации гетероциклов : Сборник / Под редакцией В. Г. Карцева. — М.: IBS PRESS, 2003. — Т. 2. — С. 414. — ISBN 5-93584-009-Х.
- ↑ Зайцев Ю. Ацетиленовый фонарь // Химия и жизнь. — М., 1971. — № 6. — С. 84—85.
- ↑ Acetylene lighting with piezo ignition (англ.). Petzl. Архивировано из первоисточника 23 августа 2011. Проверено 19 августа 2009.
Литература
- Миллер С. Ацетилен, его свойства, получение и применение / Пер. с английского. — М.: «Наука», 1969. — 680 с.
- Общая органическая химия. Стереохимия, углеводороды, галогенсодержащие соединения = Comprehensive Organic Chemistry / Под ред. Д.Бартона и В.Д.Оллиса. — М.: «Химия», 1981. — Т. 1. — С. 257-270.
- Темкин О.Н., Шестаков Г.К., Трегер Ю.А. Ацетилен: Химия. Механизмы реакций. Технология. — М.: «Химия», 1991. — 416 с. — ISBN 5724505746
- Темкин О.Н., Флид Р.М. Каталитические превращения ацетиленовых соединений в растворах комплексов металлов. — М.: «Наука», 1968. — 212 с.
- Трофимов Б.А. Гетероатомные производные ацетилена. — М.: «Наука», 1981. — 319 с.
- Henning Hopf Polyynes, Arynes, Enynes, and Alkynes / Houben-Weyl Methods of Organic Chemistry. Series Science of synthesis (V. 43). — 5. — Thieme Medical Pub, 2008. — 850 p. — ISBN 9783131189615
Ссылки
- Углеводороды ацетиленовые // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Иллюстративные материалы лекций по органической химии профессора Ненайденко В. Г., лекция №11 (Ацетилены. Реакционная способность. Аллены.)
Углеводороды Алканы Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан ... Алкены Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен ... Алкины Ацетилен • Пропин • Бутин Диены Пропадиен • Бутадиен • Изопрен Другие ненасыщеные Винилацетилен • Диацетилен Циклоалканы Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан Ароматические Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан Полициклические Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен Эта статья входит в число хороших статей русскоязычного раздела Википедии. Категории:- Алкины
- Углеводороды
- Функциональные группы
Wikimedia Foundation. 2010.