- Фтор
-
9 Кислород ← Фтор → Неон Внешний вид простого вещества  Почти бесцветный газ (в толстых слоях — зеленовато-жёлтый)[1]
Почти бесцветный газ (в толстых слоях — зеленовато-жёлтый)[1]Свойства атома Имя, символ, номер Фтор/Fluorum (F), 9
Атомная масса
(молярная масса)Электронная конфигурация [He] 2s2 2p5
Радиус атома 71 пм
Химические свойства Ковалентный радиус 72 пм
Радиус иона (-1e)133 пм
Электроотрицательность 3,98 (шкала Полинга)
Электродный потенциал 2,87 В
Степени окисления −1, 0
Энергия ионизации
(первый электрон)Термодинамические свойства простого вещества Плотность (при н. у.) (при −188,14 °C, ж.) 1,108 г/см³
Температура плавления 53,53 К (-219,62 °C)
Температура кипения 85,01 К (-188,14 °C)
Теплота плавления (F-F) 0,51 кДж/моль
Теплота испарения 6,54 (F-F) кДж/моль
Молярная теплоёмкость 31,34[2] Дж/(K·моль)
Молярный объём Кристаллическая решётка простого вещества Структура решётки моноклинная
Параметры решётки a=5,50 b=3,28 c=7,28 β=90,0 Å
Прочие характеристики Теплопроводность (300 K) 0,028 Вт/(м·К)
9 ФторF18,9982s22p5 Фтор — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), второго периода, с атомным номером 9[3]. Обозначается символом F (лат. Fluorum). Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор.
Содержание
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
Объект Содержание, Почва 0,02 Воды рек 0,00002 Воды океана 0,0001 Зубы человека[4] 0,01 В природе значимые скопления фтора содержатся в основном в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Относительно богаты фтором чечевица и лук.
Содержанием в почве фтор обязан вулканическим газам, за счёт того, что в их состав обычно входит большое количество фтороводорода.
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18Fm. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
Изотоп Относительная масса, а.е.м. Период полураспада Тип распада Ядерный спин Ядерный магнитный момент 17F 17,0020952 64,5 c β+-распад в править] Магнитные свойства ядер Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2
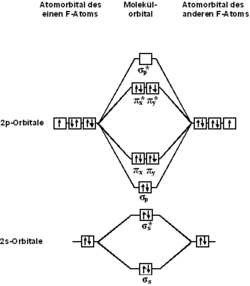
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
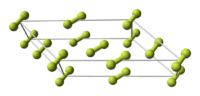
Кристаллическая решётка
Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
- α-фтор — существует при температуре меньше 45,6 K, кристаллическая решетка моноклинная, пространственная группа C 2/c, параметры a = 0,550 нм, b = 0,328 нм, c = 0,728 нм, β = 102,17°, Z = 4[5][6].
- β-фтор — существует в интервале температур 45,6 ÷ 53,53 K, кристаллическая решетка кубическая, параметры a = 0,667 нм, Z = 8.
Получение
 Лабораторный метод получения фтора
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C[7]:
- Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен, кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта (III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[8].
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[9].
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются непреодолимой для фтора пленкой фторидов[10]).
Применение
Применение в химии
Газообразный фтор используется для получения:
- гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
- трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
- шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
- фреонов — хороших хладагентов
- тефлонов — химически инертных полимеров
- гексафтороалюмината натрия — для последующего получения алюминия электролизом
- различных соединений фтора
Ракетная техника
Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива.
Применение в медицине
Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил и др.).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно[11].
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50% [12].
Предельно допустимая концентрация связанного фтора[13] в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
См. также

Фтор на Викискладе? - Фториды
- Соединения фтора в ракетной технике
- Соединения фтора в медицине
- Категория:Соединения фтора
Литература
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
- L. Pauling, I. Keaveny, and A.B. Robinson, J. Solid State Chem., 1970, 2, p. 225. англ. — Подробней о кристаллической структуре фтора
Примечания
- ↑ http://www.xumuk.ru/nekrasov/vii-01.html
- ↑ Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 198.
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Главным образом в эмали зубов
- ↑ Journal of Solid State Chemistry, Vol. 2, Issue 2, 1970, P. 225—227.
- ↑ J. Chem. Phys. 49, 1902 (1968)
- ↑ Гринвуд Н., Эрншо А. «Химия элементов» т.2, М.: БИНОМ. Лаборатория знаний, 2008 стр. 147—148, 169 — химический синтез фтора
- ↑ Ахметов Н. С. «Общая и неорганическая химия».
- ↑ Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- ↑ Фтор в Популярной библиотеке химических элементов
- ↑ По данным National Toxicology Program
- ↑ Справочник потребителя. Журнал без рекламы
- ↑ в виде фторидов и фторорганических соединений
Ссылки
- Фтор на Webelements
- Фтор в Популярной библиотеке химических элементов
- Информация о Перфторане
- Кровезаменитель Перфторан // Вестник РАН, 1997, том 67, N 11, с. 998—1013
- Фтор
Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Fl Uup Lv Uus Uuo Щелочные металлы Щёлочноземельные металлы Лантаноиды Актиноиды Переходные металлы Другие металлы Металлоиды Другие неметаллы Галогены Инертные газы Соединения фтораГексафторалюминат натрия (Na3AlF6) • Гексафтороантимонат водорода (HSbF6) • Гексафторид платины (PtF6) • Гексафторид селена (SeF6) • Гексафторид теллура (TeF6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторогерманат рубидия (Rb2[GeF6]) • Гексафторогерманат цезия (Cs2[GeF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторосиликат натрия (Na2SiF6) • Гексафторплатинат ксенона (XePtF6) • Гексафторсиликат аммония ((NH4)2SiF6) • Гептафторид рения (ReF7) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрофторид аммония ([NH4][HF2]) • Гидрофторид калия (HF2K) • Декафторид дисеры (S2F10) • Диоксидифторид (F2O2) • Диоксидифторид молибдена(VI) (MoF2O2) • Дифтордиазин (N2F2) • Дифторид радона (F2Rn) • Кремнефтористоводородная кислота (H2SiF6) • Монофторид алюминия (AlF) • Монофторид углерода (CF) • Оксид-фторид урана (UO2F2) • Окситетрафторид вольфрама(VI) (WOF4) • Окситетрафторид молибдена(VI) (MoOF4) • Оксифторид иттрия (YOF) • Оксифторид лантана(III) (LaOF) • Оксотетрафторид ксенона (XeOF4) • Оксотрифторид ванадия(V) (F3OV) • Пентафторид висмута (BiF5) • Пентафторид мышьяка (AsF5) • Пентафторид сурьмы (SbF5) • Пентафторид урана (UF5) • Пентафторид фосфора (PF5) • Субфторид серебра (Ag2F) • Тетрафторалюминат калия (KAlF4) • Тетрафтороборат лития (LiBF4) • Тетрафтороборат меди(II) (Cu(BF4)2) • Тетрафтороборат натрия (NaBF4) • Тетрафтороборат нитрозила (BF4NO) • Тетрафтороборат нитрония (BNO2F4) • Тетрафтороборат серебра (AgBF4) • Тетрафторборная кислота (HBF4) • Тетрафторид дибора (B2F4) • Тетрафторид кремния (SiF4) • Тетрафторид селена (SeF4) • Тетрафторид теллура (TeF4) • Тетрафторгидразин (N2F4) • Трифторид алюминия (AlF3) • Трифторид бора (BF3) • Трифторид мышьяка (AsF3) • Трифторид висмута (BiF3) • Трифторид сурьмы (SbF3) • Трифторид тиазила (NSF3) • Трифторид фосфора (PF3) • Фторфосфат натрия (Na2PFO3) • Фторамин (NH2F) • Фторид азота(III) (NF3) • Фторид аммония (NH4F) • Фторид бария (BaF2) • Фторид бериллия (BeF2) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Фторид ванадия(III) (VF3) • Фторид ванадия(IV) (VF4) • Фторид ванадия(V) (VF5) • Фторид вольфрама(VI) (WF6) • Фторид галлия(III) (GaF3) • Фторид гафния(IV) (HfF4) • Фторид дейтерия (DF) • Фторид диртути(2+) (Hg2F2) • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Фторид золота(III) (AuF3) • Фторид золота(V) (AuF5) • Фторид индия(III) (InF3) • Фторид иода(I) (IF) • Фторид иода(III) (IF3) • Фторид иода(V) (IF5) • Фторид иода(VII) (IF7) • Фторид иридия(IV) (IrF4) • Фторид иридия(V) (IrF5) • Фторид иридия(VI) (IrF6) • Фторид иттербия(III) (YbF3) • Фторид иттрия (YF3) • Фторид иттрия-лития (LiYF4) • Фторид кадмия (CdF2) • Фторид калия (KF) • Фторид кальция (CaF2) • Фторид кислорода(II) (OF2) • Фторид кобальта(II) (CoF2) • Фторид кобальта(III) (CoF3) • Фторид криптона(II) (KrF2) • Фторид ксенона(II) (XeF2) • Фторид ксенона(IV) (XeF4) • Фторид ксенона(VI) (XeF6) • Фторид лития (LiF) • Фторид магния (MgF2) • Фторид марганца(II) (MnF2) • Фторид марганца(III) (MnF3) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Фторид молибдена(VI) (MoF6) • Фторид натрия (NaF) • Фторид никеля(II) (NiF2) • Фторид ниобия(V) (NbF5) • Фторид нитрозила) (NOF) • Фторид оксида азота(IV) (NO2F) • Фторид оксида серы(IV) (SO2F2) • Фторид олова(II) (SnF2) • Фторид олова(IV) (SnF4) • Фторид плутония(III) (PuF3) • Фторид плутония(IV) (PuF4) • Фторид плутония(VI) (PuF6) • Фторид радия (RaF2) • Фторид рения(IV) (ReF4) • Фторид рения(VI) (ReF6) • Фторид рения(VII) (ReF7) • Фторид ртути(II) (HgF2) • Фторид рубидия (RbF) • Фторид самария(III) (SmF3) • Фторид свинца(II) (PbF2) • Фторид серебра(I) (AgF) • Фторид серебра(II) (AgF2) • Фторид серы(IV) (SF4) • Фторид серы(VI) (SF6) • Фторид скандия(III) (ScF3) • Фторид стронция (SrF2) • Фторид таллия(I) (TlF) • Фторид тантала(V) (TaF5) • Фторид теллура(IV) (TeF4) • Фторид технеция(VI) (TcF6) • Фторид тиазила (NSF) • Фторид тианила (SOF2) • Фторид титана(III) (TiF3) • Фторид титана(IV) (TiF4) • Фторид тория(IV) (ThF4) • Фторид урана(III) (UF3) • Фторид урана(IV) (UF4) • Фторид урана(V) (UF5) • Фторид урана(VI) (UF6) • Фторид хлора(I) (ClF) • Фторид хлора(III) (ClF3) • Фторид хлора(V) (ClF5) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фторид цезия (CsF) • Фторид цинка (ZnF2) • Фторид циркония(IV) (ZrF4) • Фторид-хлорид оксида серы(IV) (ClFO2S) • Фторноватистая кислота (HOF) • Фтороводород (HF) • Фторосульфоновая кислота (FSO3H) • Фторид хлорила (ClO2F) • Фторид перхлорила (ClO3F) • Фторид оксиперхлорила (ClO3OF)
Органические соединения фтора Алканы и циклоалканы Фреоны · Перфторуглеводороды · Тетрафторид углерода
Гексафторэтан · Октафторпропан · Октафторциклобутан · Декафторбутан · Фтороформ · Тетрафторэтан
Хлорфторуглероды · Трихлорфторметан · Дифтордихлорметан
Хлордифторметан · Фторотан · ПерфтордекалинАлкены и алкины Фторолефины · Тетрафторэтилен · Трифторхлорэтилен · Винилиденфторид · Винилфторид · Перфторизобутилен · Гексафторпропилен Спирты и кетоны Трифторэтанол · Фторэтанол · Гексафторацетон Кислоты и ангидриды Трифторуксусная кислота · Фторуксусная кислота · Олигомеры гексафторпропиленоксида · Карбонилфторид Элементоорганические соединения (N,S,P) Трифторметилфенотиазин · Трифтазин · Фторацизин · Фторафур · Фторфеназин · Фторурацил · Зарин · Зоман Ароматические соединения Гексафторбензол · Октафтортолуол · Бензотрифтоид Высокомолекулярные соединения Фторопласты · Политетрафторэтилен · Поливинилиденфторид · Фторкаучуки Категории:- Химические элементы
- Фториды
- Галогены
- Неметаллы
- Высокоопасные вещества
- Фтор
Wikimedia Foundation. 2010.
Синонимы:
Полезное
Смотреть что такое "Фтор" в других словарях:
фтор — фтор, а … Русский орфографический словарь
фтор — фтор/ … Морфемно-орфографический словарь
фтор — а; м. [от греч. phthoros гибель, разрушение] Химический элемент (F), светло жёлтый газ с едким запахом. Добавлять в питьевую воду ф. * * * фтор (лат. Fluorum), химический элемент VII группы периодической системы, относится к галогенам. Свободный… … Энциклопедический словарь
ФТОР — (лат. Fluorum) F, химический элемент VII группы периодической системы Менделеева, атомный номер 9, атомная масса 18,998403, относится к галогенам. Бледно желтый газ с резким запахом, tпл ?219,699 .С, tкип ?188,200 .С, плотность 1,70 г/см³.… … Большой Энциклопедический словарь
Фтор — F (от греч. phthoros гибель, разрушение, лат. Fluorum * a. fluorine; н. Fluor; ф. fluor; и. fluor), хим. элемент VII группы периодич. системы Mенделеева, относится к галогенам, ат. н. 9, ат. м. 18,998403. B природе 1 стабильный изотоп 19F … Геологическая энциклопедия
ФТОР — (Fluorum), F, химический элемент VII группы периодической системы, атомный номер 9, атомная масса 18,9984; относится к галогенам; газ, tкип 188,2шC. Фтор используют в производстве урана, хладонов, медицинских препаратов и других, а также в… … Современная энциклопедия
Фтор — (Fluorum), F, химический элемент VII группы периодической системы, атомный номер 9, атомная масса 18,9984; относится к галогенам; газ, tкип 188,2°C. Фтор используют в производстве урана, хладонов, медицинских препаратов и других, а также в… … Иллюстрированный энциклопедический словарь
ФТОР — (символ F), газообразный токсичный элемент группы ГАЛОГЕНОВ (элементы VII группы периодической таблицы), впервые выделенный в 1886 г. Его основными источниками являются флюорит и криолит. Это бледно желтое вещество, получаем в результате… … Научно-технический энциклопедический словарь
ФТОР — ФТОР, фтора, муж. (греч. phthoros гибель) (хим.). Химический элемент, бесцветный газ с едким запахом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ФТОР — ФТОР, а, муж. Химический элемент, ядовитый бесцветный газ с едким запахом. | прил. фтористый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ФТОР — ФТОР, см. флюор. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля