- Кислоты
-
У этого термина существуют и другие значения: Кислота (наркотик)
Кисло́ты — один из основных классов химических соединений. Они получили своё название из-за кислого вкуса большинства кислот, таких, как азотная или серная. По определению кислота — это электролит (вещество, участвующее в реакциях с переходом электрона), отдающий электрон в реакции с основанием, то есть веществом, принимающим электрон. В свете теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации из катионов образуются лишь катионы водорода.
Содержание
Определение кислоты
Полная статья теории кислот и оснований.
В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
В настоящее время наиболее распространены три теории кислоты и оснований. Они не противоречат друг другу, а дополняют:
- по теории сольвосистем, начало которой положили работы американских химиков Кэди и Франклина, опубликованные в 1896—1905 гг., кислота — такое соединение, которое даёт в растворе те положительные ионы, которые образуются при собственной диссоциации растворителя (Н3О+, NH4+). Это определение хорошо тем, что не привязано к водным растворам;
- по протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Йоханнесом Брёнстедом и английским учёным Томасом Лоури, кислоты — водородсодержащие вещества, отдающие при реакциях положительные ионы водорода — протоны. Слабость этой теории в том, что она не включает в себя не содержащие водорода вещества, проявляющие кислотные свойства, так называемые апротонные кислоты;
- по электронной теории, предложенной в 1923 г. американским физикохимиком Гилбертом Льюисом, кислота — вещество, принимающее электронные пары, то есть акцептор электронных пар.. Таким образом, в теории Гилберта Льюиса кислотой могут быть как молекула, так и катион, обладающие низкой по энергии свободной молекулярной орбиталью;
- Пирсон модифицировал теорию Льюиса с учётом характеристик орбиталей-акцепторов, введя понятие жёстких и мягких кислот и оснований (принцип Пирсона или принцип ЖМКО). Жёсткие кислоты характеризуются высокой электроотрицательностью и низкой поляризуемостью атома, несущего свободную орбиталь, мягкие кислоты, соответственно, характеризуются низкой электроотрицательностью и высокой поляризуемостью атома, несущего свободную орбиталь.
Следует также отметить, что многие вещества проявляют амфотерные свойства, то есть ведут себя как кислоты в реакциях с основаниями и как основания — в реакциях с более сильной кислотой.
Классификация кислот
- По содержанию кислорода
- По основности — количество кислых атомов водорода
- Одноосновные (HPO3);
- Двухосновные (H2SeO4, Азелаиновая кислота);
- Трёхосновные (H3PO4).
- По силе
- Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10-3 (HNO3);
- Слабые — константа диссоциации меньше 1·10-3 (уксусная кислота Kд= 1,7·10-5).
- По устойчивости
- По принадлежности к классам химических соединений
- По летучести
- По растворимости в воде
Химические свойства кислот
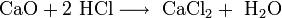
- Взаимодействие с амфотерными оксидами с образованием соли и воды:
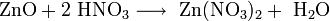
- Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
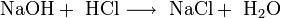
- Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
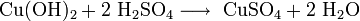
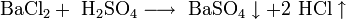
- Сильные кислоты вытесняют более слабые из их солей:
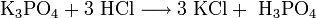
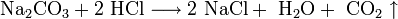
(в данном случае образуется непрочная угольная кислота
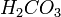 , которая сразу же распадается на воду и углекислый газ)
, которая сразу же распадается на воду и углекислый газ)- Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты
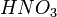 любой концентрации и концентрированной серной кислоты
любой концентрации и концентрированной серной кислоты 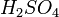 ), если образующаяся соль растворима:
), если образующаяся соль растворима:
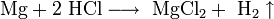
-
- С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
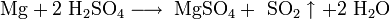
- Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
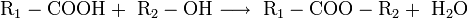
Например,
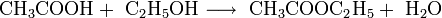
Некоторые распространённые кислоты
Неорганические кислоты
- Серная кислота
- Соляная кислота
- Ортофосфорная кислота
- Ортокарбоновая кислота
- Азотная кислота
- Борная кислота
- Сернистая кислота
- Сероводородная кислота
- Фтороводородная кислота
- Йодоводородная кислота
- Хлористая кислота
- Азотистая кислота
- Бромоводородная кислота
- Кремниевая кислота
- Марганцовая кислота
- Угольная кислота
Органические кислоты
- Муравьиная кислота
- Уксусная кислота
- Лимонная кислота
- Молочная кислота
- Щавелевая кислота
- Масляная кислота
- Аскорбиновая кислота (витамин C)
- Нитрилотриуксусная кислота
- Салициловая кислота
- Лизергиновая кислота
- Дезоксирибонуклеиновая кислота(ДНК)
- Азелаиновая кислота
Интересные факты
- Подземное животное голый землекоп имеет нечувствительные к кислоте клетки кожи даже при pH менее 3,5. [1]
- У крокодила в желудке pH бывает меньше 0,5.
Примечания
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
См. также
Wikimedia Foundation. 2010.
