- Трифторид алюминия
-
Трифторид алюминия 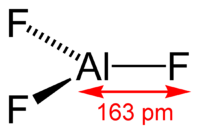
Общие Традиционные названия трифторид алюминия, фторид алюминия, алюминия трифторид Химическая формула AlF3 Физические свойства Состояние (ст. усл.) белое твердое кристаллическое вещество без запаха Молярная масса (ангидрид) 83.9767
(моногидрат) 101.022
(тригидрат) 138.023 г/моль
Плотность 2,88 г/см³ Термические свойства Температура плавления 1291 °C Молярная теплоёмкость (ст. усл.) 75,10 Дж/(моль·К) Энтальпия образования (ст. усл.) −1510 кДж/моль Удельная теплота испарения (возгонка) 272 Дж/кг Химические свойства Растворимость в воде (при 0 °C) 0.56
(при 20 °C) 0.67
(при 100 °C) 1.72 г/100 мл
Структура Кристаллическая структура ромбоэдрическая Классификация Рег. номер CAS 7784-18-1 (ангидрид),
32287-65-3 (моногидрат)
15098-87-0 (тригидрат)
Рег. номер EINECS 232-051-1 (ангидрид) RTECS BD0725000 Безопасность Токсичность Фторид алюминия — неорганическое бинарное соединение алюминия и фтора. Химическая формула AlF3.
Содержание
Физические свойства
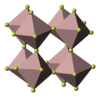
Фторид алюминия представляет из себя бесцветное или белое кристаллическое вещество. При сильном нагревании возгоняется без разложения. При обычных условиях устойчива α-модификация с тригональной решеткой (а = 0,5039 нм, α = 58,50°, z = 2, пространственная группа R32), плотность 2,882 г/см³. При нагревании до ~700 °C переходит в γ-модификацию с тетрагональной решеткой (а = 0,354 нм, с = 0,600 нм).
Длина связи Al—F составляет 0,163 нм. В газовой фазе, при температуре около 1000 °C, трифторид алюминия существует в виде молекул тригональной симметрии D3h.
Фторид алюминия плохо растворим в воде (0,41 % по массе при 25 °C), лучше — в растворах HF, не растворим в органических растворителях.
Получение
Взаимодействием Аl2О3 или Аl(ОН)3 с раствором HF с последующим выделением, сушкой и прокаливанием при 500-600 °C образовавшегося кристаллогидрата AlF3·3H2O:
Действием на Аl2О3 газообразного HF при 450-600 °C:
По реакции:
с последующем выделением, сушкой и прокаливанием гидрата.
При температуре в 700 °C гексафторсиликат натрия с алюминием дают на выходе чистый кремний, гексафторалюминат натрия и трифторид алюминия:
Самым легким путем получения трифторида алюминия является прямой контакт фтора с алюминием при температуре 600 °C:
Нагрев до температуры примерно 175 °C моногидрат трифторида алюминия получим воду и трифторид алюминия:
Для получения чистого безводного трифторида алюминия нужно гексафторалюминат аммония нагреть и получится трифторид алюминия с фторидом аммония:
В основном трифторид алюминия получают при обработке оксида алюминия гексафторсиликоновой кислотой, где на выходе получается оксид кремния(IV), трифторид алюминия и вода:
Кроме того, он изготавливается путем термического разложения аммония гексафторалюмината.
Химические свойства
Образует кристаллогидраты с 1, 3 и 9 молекулами воды, которые легко разрушаются при нагревании:
При нагревании гидролизуется парами воды:
Медленно взаимодействует с концентрированной серной кислотой H2SO4:
Разлагается растворами и расплавами щелочей.
С фторидами щелочных металлов AlF3 образует фтороалюминаты, например, гексафтороалюминат натрия Na3[AlF6]:
Применение
- Трифторид алюминия используется как компонент электролита (примерно 5-15 %) при электролитическом производстве алюминия. Совместно с другими применяемыми добавками в электролит (фторид кальция, фторид магния, фторид лития), он уменьшает температуру плавления электролита до 930-950 °C и повышает эффективность процесса электролиза (увеличивается выход по току, уменьшается удельный расход электроэнергии).
- Входит в состав флюсов, эмалей, стекол, глазурей, керамики, покрытий сварочных электродов; является катализатором в органическом синтезе.
- Как антисептик для предотвращения брожения;
- В производстве киноплёнки.
Растворимость кислот, оснований и солей в водеH+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? Соединения алюминияАлюминат лития (LiAlO2) • Алюминат натрия (NaAlO2) • Алюмогидрид кальция (Ca[AlH4]2) • Алюмогидрид лития (LiAlH4) • Алюмосиликаты • Антимонид алюминия (AlSb) • Арсенид алюминия (AlAs) • Ацетат алюминия (Al(CH3COO)3) • Бромид алюминия (AlBr3) • Гексафтороалюминат аммония ((NH3)3[AlF6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гидрид алюминия (AlH3) • Гидроксид алюминия (Al(OH)3) • Диборид алюминия (AlB2) • Додекаборид алюминия (AlB12) • Иодид алюминия (AlI3) • Карбид алюминия (Al4C3) • Метагидроксид алюминия (AlO(OH)) • Молибдат алюминия (Al2(MoO4)3) • Монооксид алюминия (AlO) • Монофторид алюминия (AlF) • Монохлорид алюминия (AlCl) • Нитрат алюминия (Al(NO3)3) • Нитрид алюминия (AlN) • Оксид алюминия (Al2O3) • Оксинитрид алюминия (AlON) • Селенид алюминия (Al2Se3) • Силикат алюминия (Al2SiO5) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюминия-калия (KAl(SO4)2) • Сульфид алюминия (Al2S3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоалюминат натрия (Na[AlH4]) • Тетрагидридоалюминат калия (K[AlH4]) • Тетрагидридоалюминат цезия (Cs[AlH4]) • Триизобутилалюминий (Al(C4H9)3) • Триметилалюминий (Al(CH3)3) • Трифенилалюминий (Al(C6H5)3) • Трифторид алюминия (AlF3) • Триэтилалюминий (Al(C2H5)3) • Фосфат алюминия (AlPO4) • Фосфид алюминия (AlP) • Хлорид алюминия (AlCl3)
Соединения фтораГексафторалюминат натрия (Na3AlF6) • Гексафтороантимонат водорода (HSbF6) • Гексафторид платины (PtF6) • Гексафторид селена (SeF6) • Гексафторид теллура (TeF6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторогерманат рубидия (Rb2[GeF6]) • Гексафторогерманат цезия (Cs2[GeF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторосиликат натрия (Na2SiF6) • Гексафторплатинат ксенона (XePtF6) • Гексафторсиликат аммония ((NH4)2SiF6) • Гептафторид рения (ReF7) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрофторид аммония ([NH4][HF2]) • Гидрофторид калия (HF2K) • Декафторид дисеры (S2F10) • Диоксидифторид (F2O2) • Диоксидифторид молибдена(VI) (MoF2O2) • Дифтордиазин (N2F2) • Дифторид радона (F2Rn) • Кремнефтористоводородная кислота (H2SiF6) • Монофторид алюминия (AlF) • Монофторид углерода (CF) • Оксид-фторид урана (UO2F2) • Окситетрафторид вольфрама(VI) (WOF4) • Окситетрафторид молибдена(VI) (MoOF4) • Оксифторид иттрия (YOF) • Оксифторид лантана(III) (LaOF) • Оксотетрафторид ксенона (XeOF4) • Оксотрифторид ванадия(V) (F3OV) • Пентафторид висмута (BiF5) • Пентафторид мышьяка (AsF5) • Пентафторид сурьмы (SbF5) • Пентафторид урана (UF5) • Пентафторид фосфора (PF5) • Субфторид серебра (Ag2F) • Тетрафторалюминат калия (KAlF4) • Тетрафтороборат лития (LiBF4) • Тетрафтороборат меди(II) (Cu(BF4)2) • Тетрафтороборат натрия (NaBF4) • Тетрафтороборат нитрозила (BF4NO) • Тетрафтороборат нитрония (BNO2F4) • Тетрафтороборат серебра (AgBF4) • Тетрафторборная кислота (HBF4) • Тетрафторид дибора (B2F4) • Тетрафторид кремния (SiF4) • Тетрафторид селена (SeF4) • Тетрафторид теллура (TeF4) • Тетрафторгидразин (N2F4) • Трифторид алюминия (AlF3) • Трифторид бора (BF3) • Трифторид мышьяка (AsF3) • Трифторид висмута (BiF3) • Трифторид сурьмы (SbF3) • Трифторид тиазила (NSF3) • Трифторид фосфора (PF3) • Фторфосфат натрия (Na2PFO3) • Фторамин (NH2F) • Фторид азота(III) (NF3) • Фторид аммония (NH4F) • Фторид бария (BaF2) • Фторид бериллия (BeF2) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Фторид ванадия(III) (VF3) • Фторид ванадия(IV) (VF4) • Фторид ванадия(V) (VF5) • Фторид вольфрама(VI) (WF6) • Фторид галлия(III) (GaF3) • Фторид гафния(IV) (HfF4) • Фторид дейтерия (DF) • Фторид диртути(2+) (Hg2F2) • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Фторид золота(III) (AuF3) • Фторид золота(V) (AuF5) • Фторид индия(III) (InF3) • Фторид иода(I) (IF) • Фторид иода(III) (IF3) • Фторид иода(V) (IF5) • Фторид иода(VII) (IF7) • Фторид иридия(IV) (IrF4) • Фторид иридия(V) (IrF5) • Фторид иридия(VI) (IrF6) • Фторид иттербия(III) (YbF3) • Фторид иттрия (YF3) • Фторид иттрия-лития (LiYF4) • Фторид кадмия (CdF2) • Фторид калия (KF) • Фторид кальция (CaF2) • Фторид кислорода(II) (OF2) • Фторид кобальта(II) (CoF2) • Фторид кобальта(III) (CoF3) • Фторид криптона(II) (KrF2) • Фторид ксенона(II) (XeF2) • Фторид ксенона(IV) (XeF4) • Фторид ксенона(VI) (XeF6) • Фторид лития (LiF) • Фторид магния (MgF2) • Фторид марганца(II) (MnF2) • Фторид марганца(III) (MnF3) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Фторид молибдена(VI) (MoF6) • Фторид натрия (NaF) • Фторид никеля(II) (NiF2) • Фторид ниобия(V) (NbF5) • Фторид нитрозила) (NOF) • Фторид оксида азота(IV) (NO2F) • Фторид оксида серы(IV) (SO2F2) • Фторид олова(II) (SnF2) • Фторид олова(IV) (SnF4) • Фторид плутония(III) (PuF3) • Фторид плутония(IV) (PuF4) • Фторид плутония(VI) (PuF6) • Фторид радия (RaF2) • Фторид рения(IV) (ReF4) • Фторид рения(VI) (ReF6) • Фторид рения(VII) (ReF7) • Фторид ртути(II) (HgF2) • Фторид рубидия (RbF) • Фторид самария(III) (SmF3) • Фторид свинца(II) (PbF2) • Фторид серебра(I) (AgF) • Фторид серебра(II) (AgF2) • Фторид серы(IV) (SF4) • Фторид серы(VI) (SF6) • Фторид скандия(III) (ScF3) • Фторид стронция (SrF2) • Фторид таллия(I) (TlF) • Фторид тантала(V) (TaF5) • Фторид теллура(IV) (TeF4) • Фторид технеция(VI) (TcF6) • Фторид тиазила (NSF) • Фторид тианила (SOF2) • Фторид титана(III) (TiF3) • Фторид титана(IV) (TiF4) • Фторид тория(IV) (ThF4) • Фторид урана(III) (UF3) • Фторид урана(IV) (UF4) • Фторид урана(V) (UF5) • Фторид урана(VI) (UF6) • Фторид хлора(I) (ClF) • Фторид хлора(III) (ClF3) • Фторид хлора(V) (ClF5) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фторид цезия (CsF) • Фторид цинка (ZnF2) • Фторид циркония(IV) (ZrF4) • Фторид-хлорид оксида серы(IV) (ClFO2S) • Фторноватистая кислота (HOF) • Фтороводород (HF) • Фторосульфоновая кислота (FSO3H) • Фторид хлорила (ClO2F) • Фторид перхлорила (ClO3F) • Фторид оксиперхлорила (ClO3OF)
Категории:- Соединения алюминия
- Фториды
- Неорганические вещества
- Бинарные соединения
- Галогениды металлов
-
Wikimedia Foundation. 2010.





![~\mathsf{3Na_2[SiF_6]+4Al \xrightarrow{700^oC} \ 3Si+2Na_3[AlF_6]+2AlF_3}](095c1e2c244dd23fcac6b485cd65cfe0.png)








![\mathsf{4AlF_3 + 4NaOH \xrightarrow{} Na[Al(OH)_4] + 3Na[AlF_4]}](083e6100f14c48f6a85fc688a371ac93.png)
![\mathsf{AlF_3 + 3NaF \xrightarrow{} Na_3[AlF_6]}](0ef5579ef12b4efd0f5c13a38800e450.png)