- Реакции нуклеофильного замещения
-
Реакции нуклеофильного замещения (англ. nucleophilic substitution reaction) — реакции замещения, в которых атаку осуществляет нуклеофил — реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг.
Все нуклеофилы являются основаниями Льюиса.
Общий вид реакций нуклеофильного замещения:
- R−X + Y− → R−Y + X− (анионный нуклеофил)
- R−X + Y−Z → R−Y + X−Z (нейтральный нуклеофил)
Выделяют реакции алифатического (широко распространены) и ароматического (мало распространены) нуклеофильного замещения.
Реакции алифатического нуклеофильного замещения играют крайне важную роль в органическом синтезе и широко используются как в лабораторной практике, так и промышленности.
Стройную теорию, описывающую механизм реакций нуклеофильного замещения, обобщив имеющиеся факты и наблюдения, разработали в 1935 году английские учёные Эдвард Хьюз и Кристофер Ингольд[2].
Содержание
Реакции алифатического нуклеофильного замещения
Реакции SN1
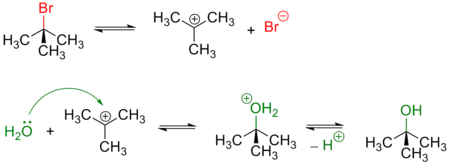
Механизм реакции SN1 или реакции мономолекулярного нуклеофильного замещения (англ. substitution nucleophilic unimolecular) включает следующие стадии:
1. Ионизация субстрата с образованием карбкатиона (медленная стадия):
- R−X → R+ + X−
2. Нуклеофильная атака карбкатиона (быстрая стадия):
- R+ + Y− → R−Y
или (если в качестве нуклеофила выступает нейтральная частица):
- R+ + Y−Z → R−Y+−Z
3. Отщепление катиона (быстрая стадия):
- R−Y+−Z → R−Y + Z+
Примером реакции SN1 является гидролиз трет-бутилбромида:
Условный энергетический профиль реакции мономолекулярного нуклеофильного замещения представлен на диаграмме[3].
Скорость реакции SN1 (в упрощённом виде) не зависит от концентрации нуклеофила и прямо пропорциональна концентрации субстрата[4]:
- Скорость реакции = k × [RX]
Так как в процессе реакции образуется карбкатион, его атака (в идеальных условиях без учёта фактора влияния заместителей) нуклеофилом может происходить с обеих сторон, что приводит к рацемизации образующегося продукта.
Важно иметь в виду, что SN1 механизм реализуется только в случае относительной устойчивости промежуточного карбкатиона, поэтому по такому пути, обычно, реагируют только третичные ((R)3C-X) и вторичные ((R)2CH-X) алкилпроизводные.
Реакции SN2
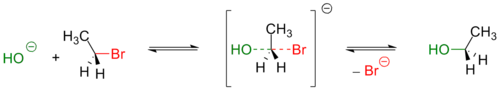
Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения (англ. substitution nucleophilic bimolecular ) происходит в одну стадию, без промежуточного образования интермедиата. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
- R−X + Y− → [Y⋯R⋯X]− → R−Y + X−
Примером реакции SN2 является гидролиз этилбромида:
Условный энергетический профиль реакции бимолекулярного нуклеофильного замещения представлен на диаграмме[3].
Скорость реакции SN2 зависит как от концентрации нуклеофила, так и концентрации субстрата[4]:
- Скорость реакции = k × [RX] × [Y]
Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является стереохимическая инверсия образующегося продукта.
Ещё в 1895 году году этот эффект обнаружил латышский химик Пауль Вальден («обращение Вальдена»), однако он не смог его объяснить[5]. В 1935 году Хьюз исследуя реакцию оптически активного 2-йодоктана с йодид-ионом обнаружил, что реакция имеет общий второй кинетический порядок и первый по каждому из реагентов, а также что скорость рацемизации в два раза выше скорости внедрения йода в молекулу йодоктана[2]. Так было сформулировано стереохимическое SN2 правило:
В реакциях бимолекулярного нуклеофильного замещения атакующий нуклеофил стереохимически инвертирует молекулу, в которой он замещает уходящую группу.
Сравнение реакций SN1 и SN2
Сравнительный фактор SN1 SN2 Скорость реакции k × [RX] k × [RX] × [Y] Стереохимический результат рацемизация инверсия Предпочтительный растворитель полярный протонный полярный апротонный Влияние структуры субстрата на скорость реакции[6]CH3-Х реакция не идёт очень хорошо R-CH2-X реакция не идёт хорошо R2CH-X реакция идёт реакция идёт R3C-X очень хорошо реакция не идёт R-CH=CH-CH2-X реакция идёт хорошо С6H5-CH2-X реакция идёт хорошо R-CO-CH2-X реакция не идёт отлично R-O-CH2-X отлично хорошо R2N-CH2-X отлично хорошо Реакции смешанного типа SN1 — SN2
Не для всех реакций можно чётко определить механизм, по которому они протекают, так как чистый SN1 или SN2 являются всего лишь идеальными (предельными) модельными случаями. Следует помнить, что один и тот же субстрат может реагировать с одним и тем же нуклеофилом, в зависимости от условий реакции и растворителя, как по механизму SN1, так и SN2.
Например, скорость гидролиза 2-бромпропана описывается с учётом смешанного механизма его протекания[7]:
- CH3−CHBr−CH3 + HO− → CH3−CHOH−CH3 + Br−
- Скорость реакции = k1 × [CH3CHBrCH3] + k2 × [CH3CHBrCH3] × [HO-]
Часто смешанный механизм провоцирует применение амбидентных нуклеофилов, то есть нуклеофилов, имеющих не менее двух атомов — доноров электронных пар (например: NO2−, CN−, NCO−, SO32− и пр.)
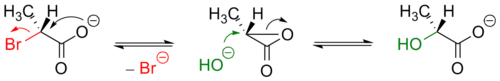
Если в субстрате имеется заместитель, находящийся рядом с атакуемым атомом и несущий свободную электронную пару, он может существенно увеличить скорость реакции нуклеофильного замещения и повлиять на её механизм (сохранение конфигурации). В этом случае говорят об анхимерном содействии соседней группы (например: COO−, COOR, OCOR, O−, OR, NH2, NHR, NR2 и пр.)
Примером анхимерного содействия может служить гидролиз 2-бромпропионата:
Несмотря на формальный (с точки зрения одностадийности) механизм SN2, образующийся в ходе реакции продукт имеет ту же оптическую конфигурацию, что и исходный.
Реакции SNi
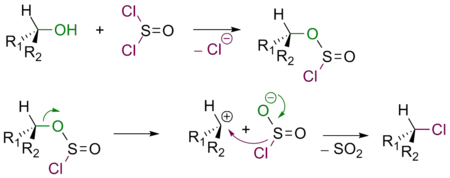
Механизм реакции SNi или реакции внутримолекулярного нуклеофильного замещения (англ. substitution nucleophilic internal) протекает в несколько стадий по аналогии с механизмом SN1, однако часть уходящей группы при этом атакует субстрат, отщепляясь от оставшейся части.
Общая схема реакции:
1. Ионизация субстрата:2. Нуклеофильная атака:
На первом этапе субстрат диссоциирует с образованием т. н. контактной ионной пары. Компоненты такой пары находятся очень близко друг от друга, поэтому атака нуклеофила вынужденно происходит с той же стороны, где до этого находилась уходящая группа.
Реакции, протекающие по механизму SNi, крайне редки. Одним из примеров может служить взаимодействие спирта с SOCl2:[1]
Из схемы видно, что в реакций SNi конфигурация реакционного центра остается неизменной.
Факторы, влияющие на реакционную способность
Влияние природы нуклеофила
Природа нуклеофила оказывает существенное влияние на скорость и механизм реакции замещения. Фактором, количественно описывающим это влияние является нуклеофильность — относительная величина, характеризующая способность влияния реагента на скорость химической реакции нуклеофильного замещения.
Нуклеофильность — величина кинетическая, т. е. есть влияет исключительно на скорость реакции. Этим она принципиально отличается от основности, которая является термодинамической величиной[8], и определяет положение равновесия.
В идеальном случае природа нуклеофила не влияет на скорость реакции SN1, так как лимитирующая стадия этого процесса от этого не зависит. В то же время, природа реагента может оказать влияние на ход процесса и конечный продукт реакции.
Для реакций SN2 можно выделить следующие принципы, по которым определяется влияние природы нуклеофила[4]:
- Отрицательно заряженный нуклеофил (например, NH2-) всегда сильнее, чем его сопряженная кислота (NH3), при условии, что она также проявляет нуклеофильные свойства.
- При сравнении нуклеофилов, атакующие атомы которых находятся в одном периоде периодической системы им. Д. И. Менделеева, изменение их силы соответствует изменению их основности:
- Сверху вниз в периодической системе нуклеофильность обычно возрастает:
- Исключение из предыдущего пункта:
- Чем свободнее нуклеофил, тем он сильнее.
- Если в положении, соседствующем с атакуемым атомом имеются свободные электронные пары, нуклеофильность возрастает (α-эффект):
Следует иметь в виду, что нуклеофильность различных реагентов сравнивают по отношению к некоторому выбранному стандарту при условии соблюдения идентичности условий проведения реакции (термодинамические параметры и растворитель). На практике для реакций SN2 применяют уравнение Свена-Скотта[8]:
 ,
,
где:
 — константы скорости реакции субстрата с данным нуклеофилом и водой (или иным стандартом, например — метанолом);
— константы скорости реакции субстрата с данным нуклеофилом и водой (или иным стандартом, например — метанолом);
 — параметр чувствительности субстрата к изменению нуклеофила (в качестве стандартного нуклеофила, когда S = 1, выбирают CH3Br или CH3I);
— параметр чувствительности субстрата к изменению нуклеофила (в качестве стандартного нуклеофила, когда S = 1, выбирают CH3Br или CH3I);
 — параметр нуклеофильности.
— параметр нуклеофильности.Влияние уходящей группы
Фактором, количественно описывающим влияние уходящей группы является нуклеофугность — относительная величина, характеризующая способность влияния нуклеофуга на скорость химической реакции нуклеофильного замещения.
Для описания нуклеофугности, обычно, трудно подобрать один параметр, который исчерпывающе определил бы зависимость скорости реакции от природы уходящей группы. Часто, в качестве меры нуклеофугности для реакций SN1 служат константы сольволиза.
Эмпирически можно руководствоваться следующим правилом — уходящая группа отщепляется тем легче, тем стабильнее она как самостоятельная частица[4].
Хорошими нуклеофугами являются следующие группы:

Влияние растворителя
Очевидно, что для реакций SN1, чем выше полярность растворителя, тем выше скорость реакции замещения (для нейтральных субстратов). Если же субстрат несёт положительный заряд, наблюдается обратная зависимость — повышение полярности растворителя замедляет реакцию. Сравнивая протонные и апротонные растворители, следует отметить, что если растворитель способен образовывать водородную связь с уходящей группой, он увеличивает скорость для нейтральных субстратов.
Для реакций SN2 влияние растворителя оценить сложнее. Если в переходном состоянии заряд распределён аналогично исходному состоянию или снижен, апротонные полярные растворители замедляют реакцию. Если такой заряд возникает только в переходном состоянии, полярные растворители реакцию ускоряют[4]. Протонные полярные растворители способны образовывать связь с анионами, что затрудняет протекание реакции[7].
На скорость реакции в апротонных растворителях также оказывает влияние и размер атакующего атома: малые атомы обладают большей нуклеофильностью.
Обобщая сказанное, можно эмпирически отметить: для большинства субстратов при увеличении полярности растворителя скорость SN1 реакций растёт, а SN2 — снижается.
Иногда оценивают влияние растворителя рассматривая его ионизирующую силу (Y), используя уравнение Уинстейна-Грюнвальда (1948 год)[9]:

где:
 — константы скорости сольволиза стандартного субстрата (в качестве стандарта используется трет-бутихлорид) в заданном и стандартном растворителе (в качестве стандарта используется 80 % об. этанол).
— константы скорости сольволиза стандартного субстрата (в качестве стандарта используется трет-бутихлорид) в заданном и стандартном растворителе (в качестве стандарта используется 80 % об. этанол). — параметр чувствительности субстрата к ионизирующей силе растворителя.
— параметр чувствительности субстрата к ионизирующей силе растворителя.Значение Y для некоторых растворителей[9]: вода: 3,493; муравьиная кислота: 2,054; метанол: −1,090; этанол (100 %): −2,033; диметилформамид: −3,500
Существует и альтернативный I-параметр, введённый в 1969 году Другаром и Декрооком. Он аналогичен Y-фактору, но в качестве снандарта была выбрана SN2 реакция между три-н-пропиламином и йодистым метилом при 20°С[9].
Типовые реакции алифатического нуклеофильного замещенияНазвание Реакция Нуклеофилы: H2O, HO-, ROH, RO- Гидролиз алкилгалогенидов 


Гидролиз ацилгалогенидов 
Гидролиз сложных эфиров 
Алкилирование алкилгалогенидами 
Образование и переэтерификация простых эфиров 
Образование и переэтерификация сложных эфиров 


Нуклеофилы: RCOOH, RCOO- Реакции алкилирования 

Реакции ацилирования 

Нуклеофилы: H2S, SH-, SR- 


Нуклеофилы: NH3, RNH2, R2NH Алкилирование аминов 

Ацилирование аминов 


Нуклеофилы: галогены и галогенпроизводные Реакция обмена галогенами 
Получение алкилгалогенидов из спиртов 


Получение алкилгалогенидов из простых и сложных эфиров 

Получение ацилгалогенидов 

Прочие нуклеофилы Реакции с металлами и металлорганическими соединениями 
Реакции с активной CH2-группой 
Реакции с участием ацетиленовой группы 
Реакции ароматического нуклеофильного замещения
Для ароматических систем более характерны реакции электрофильного замещения. В реакции нуклеофильного замещения они вступают, как правило, только в случае действия сильного нуклеофила или в достаточно жёстких условиях.
Реакции SNAr (Ареновый механизм)
Механизм реакции SNAr или реакции ароматического нуклеофильного замещения (англ. substitution nucleophilic aromatic) является наиболее важным среди реакций нуклеофильного замещения ароматических соединений и состоит из двух стадий. На первом этапе происходит присоединение нуклеофила, на втором — отщепление нуклеофуга. Иначе механизм SNAr называют механизмом присоединения-отщепления:
Образующийся в ходе реакции промежуточный комплекс, иногда достаточно устойчивый, носит название комплекса Мейзенгеймера (Майзенхаймера).
Для более эффективного и мягкого проведения реакции по механизму SNAr необходимо присутствие в ароматическом кольце электроноакцепторных заместителей (NO2, CN, COR и др.), стабилизирующих интермедиат[8].
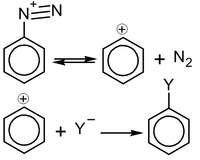
Реакции SN1
Реакции с механизмом SN1 для ароматических соединений встречаются крайне редко и, по сути, характерны только для солей диазония:
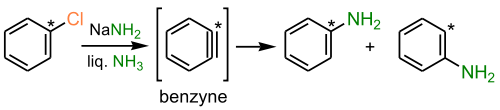
Ариновый механизм
При взаимодействии арилгалогенидов, не содержащих заместителей, с сильными основаниями (например: NaNH2) замещение идёт по ариновому механизму — через стадию образования дегидробензола:
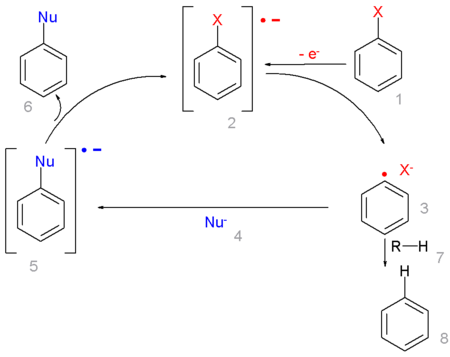
Реакции SRN1
Реакции радикально-нуклеофильного замещения (англ. substitution radical-nucleophilic unimolecular) — SRN1 — достаточно распространены среди ароматических систем. Механизм этих реакций включает стадию с участием свободных радикалов:
Реакции SRN1 инициируются и стимулируются сольватированными электронами, фотохимически или электрохимически. Наличие радикального механизма не требует для стимулирования таких реакций присутствия в субстрате активирующих групп или сильного основания.
Типичные реакции ароматического нуклеофильного замещения
- Типичные реакции арилгалогенидов
- Реакции с участием солей диазония
Примечания
- ↑ 1 2 M. B. Smith, J. March, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 6th ed., Wiley-Interscience, 2007, ISBN 978-0-471-72091-1
- ↑ 1 2 Бутин К. П. Механизмы органических реакций: достижения и перспективы (pdf). Журнал Российского химического общества им. Д. И. Менделеева, № 2, 2001 год. Химическая информационная сеть ChemNet. Архивировано из первоисточника 4 апреля 2012. Проверено 20 июля 2009.
- ↑ 1 2 Керри Ф, Сандберг Р. Углублённый курс органической химии: пер. с англ., в 2-х томах. — М.: Химия, 1981.
- ↑ 1 2 3 4 5 Mарч Дж. Органическая химия, пер. с англ., т. 2, — M.: Мир, 1988
- ↑ Пауль Вальден — биография. Краткий очерк истории химии. Кафедра физхимии РГУ. Архивировано из первоисточника 4 апреля 2012. Проверено 22 июля 2009.
- ↑ Ненайденко В. Г. Алифатическое нуклеофильное замещение. Лекция № 18 (pdf). Иллюстративный материал к курсу лекций «Органическая химия». Химическая информационная сеть ChemNet (2003). Архивировано из первоисточника 4 апреля 2012. Проверено 20 июля 2009.
- ↑ 1 2 Травень В. Ф. Органическая химия, М.: ИКЦ «Академкнига», 2004. — ISBN 5-94628-068-6.
- ↑ 1 2 3 Химическая энциклопедия./ Нуклеофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 3.
- ↑ 1 2 3 Самуилов Я. Д., Черезова Е. Н. Реакционная способность органических соединений. Учебное пособие (pdf). Мультимедийный журнал «Химия и компьютерное моделирование. Бутлеровские сообщения.» (2003). Архивировано из первоисточника 4 апреля 2012. Проверено 23 июля 2009.
Химические реакции в органической химии Реакции замещения Реакции нуклеофильного замещения · Реакции электрофильного замещения · Реакции радикального замещения Реакции присоединения Реакции нуклеофильного присоединения · Реакции электрофильного присоединения · Реакции радикального присоединения · Реакции синхронного присоединения Реакции элиминирования Реакции гетеролитического элиминирования · Реакции перициклического элиминирования · Реакции радикального элиминирования Реакции перегруппировки Нуклеофильные перегруппировки · Электрофильные перегруппировки · Радикальные перегруппировки Реакции окисления и восстановления Реакции окисления · Реакции восстановления Прочее Именные реакции в органической химии Категории:- Химические реакции
- Реакции в органической химии
- Реакции замещения
Wikimedia Foundation. 2010.