- Нитрат меди(II)
-
Нитрат меди(II) 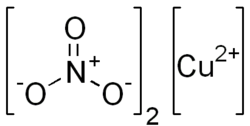

Систематическое название Нитрат меди(II)
Другие названия Медь азотнокислая
Химическая формула Cu(NO3)2
Внешний вид Бесцветные кристаллы (безводный)
Голубые кристаллы (кристаллогидраты)Свойства Молярная масса безводный: 187,55 г/моль;
тригидрат: 241,60 г/моль;
гексагидрат: 295,64 г/мольТемпература плавления безводный: 255 °C[1];
тригидрат: 114,5 °C;
гексагидрат: 24,4 °CТемпература разложения безводный: 170 °C
Плотность безводный: 3,05 г/см³;
тригидрат: 2,32 г/см³;
гегсагидрат: 2,074 г/см³Растворимость в воде 124,7 г/100 мл
Токсикологические данные LD50 тригидрат: 940 мг/кг
Структура Кристаллическая решётка безводный: ромбическая;
тригидрат: ромбическая;
гексагидрат: триклинная;
1,5- и 2,5-гидраты: моноклиннаяТермодинамические свойства Стандартная энтальпия образования безводный: −310 кДж/моль;
тригидрат: −1217 кДж/мольСтандартная молярная энтропия +192 Дж/(К·моль)
Стандартная энергия образования Гиббса −117 кДж/моль
Классификация Регистрационный номер CAS 10031-43-3
Регистрационный номер EC Безопасность R-фразы R22; R36/38; R50/53
S-фразы S61
H-фразы H272; H302; H315; H319; H410
P-фразы P210; P273; P302+P352; P305+P351+P338
Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). Нитра́т ме́ди(II) — неорганическое вещество с формулой
 , является солью двухвалентной меди и азотной кислоты. Безводный нитрат меди(II) представляет собой бесцветные гигроскопичные кристаллы. При поглощении влаги образует кристаллогидраты голубого цвета.
, является солью двухвалентной меди и азотной кислоты. Безводный нитрат меди(II) представляет собой бесцветные гигроскопичные кристаллы. При поглощении влаги образует кристаллогидраты голубого цвета.Содержание
Нахождение в природе
Нитрат меди(II) (в форме осно́вной соли) встречается в природе в виде минералов герхардтита и руаита. Свойства минералов представлены в таблице:
Герхардтит[2] Руаит[3] Состав Cu2NO3(OH)3 Cu2NO3(OH)3 Цвет зелёный темно-зелёный Сингония орторомбическая моноклинная Плотность, г/см³ 3,40—3,43 3,38 Твердость 2 2 Физические свойства
Безводный нитрат меди(II) при нормальных условиях — твердое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при 20 °C; 207,7 г/100 г H2O при 80 °C), этаноле, метаноле, этилацетате, ацетонитриле, ДМСО[4].
При кристаллизации из водных растворов образует ряд кристаллогидратов: нона-, гекса- и тригидраты. Также известны кристаллогидраты, содержащие 1,5 и 2,5 молекулы H2O. Параметры кристаллической решетки кристаллогидратов[5]:
- Cu(NO3)2·6H2O: триклинная сингония, пространственная группа P1, а = 0,591 нм, b = 0,777 нм, с = 0,543 нм, α = 97,65°, β = 93,88°, γ = 72,53°, Z = 1.
- Cu(NO3)2·3H2O: ромбическая сингония, пространственная группа Pmn21, а = 1,12 нм, b = 0,505 нм, с = 0,528 нм, Z = 4.
- Cu(NO3)2·2,5H2O: моноклинная сингония, пространственная группа I2/a, а = 1,64539 нм, b = 0,49384 нм, с = 1,59632 нм, β = 93,764°, Z = 8.
- Cu(NO3)2·1,5H2O: моноклинная сингония, пространственная группа C2/c, а = 2,22 нм, b = 0,490 нм, с = 1,54 нм, β = 48°, Z = 8.
Гексагидрат разлагается при нагревании до 100 °C в вакууме. Тригидрат разлагается при 120 °C[6].
Химические свойства
Разложение
Нитрат меди(II) при нагревании разлагается с образованием оксида меди(II) и диоксида азота:
Образовавшийся диоксид азота можно использовать для лабораторного получения азотной кислоты:
Гидролиз
Нитрат меди(II) в водном растворе диссоциирует на ионы с одновременной гидратацией катиона:
Катион тетрааквамеди(II) подвергается обратимому гидролизу:
В упрощённом виде:
Обменные реакции
В водных растворах нитрат меди(II) вступает в реакции ионного обмена, характерные для растворимых солей двухвалентной меди, например:
с щёлочью (выпадает голубой осадок)с фосфатом натрия (выпадает синий осадок)
с жёлтой кровяной солью (выпадает красный осадок)
с концентрированным раствором аммиака (раствор приобретает тёмно-синий цвет)
с азидами щелочных металлов (выпадает коричневый осадок азида меди(II))
Прочие реакции
Нитрат меди(II) реагирует с растворами гидроксиламина (при кипении) и гидразина с выпадением белого осадка азида меди(I):
Нитрат меди(II) реагирует с жидким тетраоксидом диазота с выпадением темно-зелёного осадка:
Получение
Нитрат меди(II) может быть получен растворением в азотной кислоте металлической меди, оксида меди(II) или гидроксида меди(II):
Безводный нитрат меди(II) может быть получен при взаимодействии меди с тетраоксидом диазота (реакция ведётся при 80 °C в этилацетате):
Применение
Нитрат меди(II) используют для получения чистого оксида меди(II), медьсодержащих катализаторов, как фунгицид, протраву при крашении тканей[5].
В сочетании с уксусным ангидридом используется в органическом синтезе в качестве реагента для нитрования ароматических соединений (т. н. «условия Менке»)[7].
Токсичность
Нитрат меди(II) является умеренно-токсичным веществом — LD50 для крыс перорально 950 мг/кг (тригидрат).
При контакте с кожей и слизистыми оболочками вызывает раздражение, при попадании в глаза — сильное раздражение с риском помутнения роговицы.
Представляет опасность для окружающей среды — [8]
Примечания
- ↑ При быстром нагревании или избыточном давлении.
- ↑ Герхардтит на webmineral.com. Архивировано из первоисточника 2 мая 2012.
- ↑ Руаит на webmineral.com. Архивировано из первоисточника 2 мая 2012.
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 147. — 637 с. — ISBN 978-5-358-01303-2
- ↑ 1 2 Нитрат меди на xumuk.ru. Архивировано из первоисточника 2 мая 2012.
- ↑ Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 104. — 685 с. — ISBN 5-7107-8085-5
- ↑ Menke J. B. (1925). «Nitration with nitrates». Recueil des Travaux Chimiques des Payes-Bas 44: 141.
- ↑ Merck Safety Data Sheet — Copper(II) nitrate trihydrate (pdf)
Растворимость кислот, оснований и солей в водеH+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? Соединения медиАзид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) •
НитратыДинитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2)
 Категории:
Категории:- Соединения меди
- Нитраты
- Неорганические вещества
- Фунгициды
Wikimedia Foundation. 2010.








![\mathsf{Cu(NO_3)_2 + 4\ H_2O \longrightarrow \ [Cu(H_2O)_4]^{2+} + 2\ NO_3^-}](b17d2c8ac25770f6a1118d2eac5a980a.png)
![\mathsf{[Cu(H_2O)_4]^{2+} +\ H_2O \rightleftarrows \ [Cu(H_2O)_3(OH)]^+ +\ H_3O^+} ,\ pK_a \ = 7,34](eead5a428babd744e9232a27f5050cea.png)



![\mathsf{2 Cu(NO_3)_2 +\ K_4[Fe(CN)_6] \longrightarrow \ Cu_2[Fe(CN)_6] \downarrow + 4\ KNO_3}](8408d28d195929764d7df9e667931f19.png)
_2 + 4\ H_2O}](212c0a3b0b768c3637db974ea52959fc.png)







