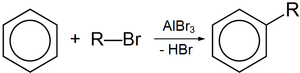- Бромид алюминия
-
Бромид алюминия 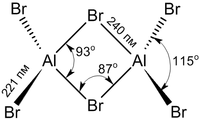
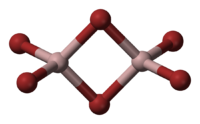
Общие Систематическое наименование Бромид алюминия Химическая формула AlBr3, Al2Br6 Эмпирическая формула AlBr3 Физические свойства Состояние (ст. усл.) твёрдое Молярная масса 266,69 г/моль Плотность 3,205[1] г/см³ Термические свойства Температура плавления 97,5[1] °C Температура кипения 255[2] °C Энтальпия образования (ст. усл.) − 514;
− 422 (AlBr3, газ);
− 971(Al2Br6, газ)[3] кДж/мольСтруктура Кристаллическая структура моноклинная Классификация Рег. номер CAS 7727-15-3 Рег. номер EINECS 231-779-7 Броми́д алюми́ния (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула
 . Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.
. Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.Содержание
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома[4].
Координационное число алюминия в молекуле бромида равно 4[5].
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль[6].
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O[7]. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне[8]; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор)[9].
Химические свойства
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
- При нагревании водного раствора гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения[10]:
- При высокой температуре разлагается:
- При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия[2]:
- С гидридом лития образует алюмогидрид:
- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы доноры (на этом, в частности, основано его применение в органическом синтезе)[7]:
Получение
Безводный бромид алюминия получают взаимодействием элементов (Al и Br2) при нагревании:

Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:

Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий[11].
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов, например[12]:

Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом[13]:

Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно)[14].
Литература
- Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — 526 p. — ISBN 0-7514-0103-X
Примечания
- ↑ 1 2 Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 74. — ISBN 5-7107-8085-5
- ↑ 1 2 Турова Н.Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 67.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Термодинамика. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 441. — ISBN 5-7107-8085-5
- ↑ Chambers C., Holliday A.K. Modern inorganic chemistry. — Chichester: Butterworth & Co (Publishers) Ltd, 1975. — P. 153.
- ↑ Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. Т.2: Химия непереходных элементов / Под ред. акад. Ю.Н.Третьякова. — М.: Издательский центр «Академия», 2004. — Т. 2. — С. 86. — ISBN 5-7695-1436-1
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 6. Энергия связи для многоатомных частиц // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 384. — ISBN 5-7107-8085-5
- ↑ 1 2 Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. — 4-е изд., исправленное. — М.: «Высшая школа», 2001. — С. 498. — ISBN 5-06-003363-5
- ↑ Алюминий // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 207.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 641. — ISBN 5-7107-8085-5
- ↑ Гофман У., Рюдорф В., Хаас А. и др. Руководство по неорганическому синтезу. — Пер. с нем., под ред. Г.Брауэра. — М.: «Мир», 1985. — Т. 3. — С. 899.
- ↑ Спиридонов Б.А., Федянин В.И. Исследование процесса электроосаждения алюминия из пара-ксилольных электролитов.. Российское общество гальванотехников и специалистов в области обработки поверхности.(недоступная ссылка — история) Проверено 26 октября 2009.
- ↑ Douwes H.S.A. The kinetics of the aluminium bromide catalyzed isomerization of 1-propyl bromide (англ.) // Journal of Molecular Catalysis A: Chemical. — 2005. — Т. 240. — № 1-2. — С. 82-90.
- ↑ Unated States Patent 2553518. Production of Organic Bromides (англ.) (pdf). FreePatentsOnline (May, 1951). Архивировано из первоисточника 9 апреля 2012. Проверено 26 октября 2009.
- ↑ Safety data for aluminium bromide (англ.). The Physical and Theoretical Chemistry Laboratory Oxford University. Архивировано из первоисточника 9 апреля 2012. Проверено 26 октября 2009.
Растворимость кислот, оснований и солей в водеH+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? Соединения алюминияАлюминат лития (LiAlO2) • Алюминат натрия (NaAlO2) • Алюмогидрид кальция (Ca[AlH4]2) • Алюмогидрид лития (LiAlH4) • Алюмосиликаты • Антимонид алюминия (AlSb) • Арсенид алюминия (AlAs) • Ацетат алюминия (Al(CH3COO)3) • Бромид алюминия (AlBr3) • Гексафтороалюминат аммония ((NH3)3[AlF6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гидрид алюминия (AlH3) • Гидроксид алюминия (Al(OH)3) • Диборид алюминия (AlB2) • Додекаборид алюминия (AlB12) • Иодид алюминия (AlI3) • Карбид алюминия (Al4C3) • Метагидроксид алюминия (AlO(OH)) • Молибдат алюминия (Al2(MoO4)3) • Монооксид алюминия (AlO) • Монофторид алюминия (AlF) • Монохлорид алюминия (AlCl) • Нитрат алюминия (Al(NO3)3) • Нитрид алюминия (AlN) • Оксид алюминия (Al2O3) • Оксинитрид алюминия (AlON) • Селенид алюминия (Al2Se3) • Силикат алюминия (Al2SiO5) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюминия-калия (KAl(SO4)2) • Сульфид алюминия (Al2S3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоалюминат натрия (Na[AlH4]) • Тетрагидридоалюминат калия (K[AlH4]) • Тетрагидридоалюминат цезия (Cs[AlH4]) • Триизобутилалюминий (Al(C4H9)3) • Триметилалюминий (Al(CH3)3) • Трифенилалюминий (Al(C6H5)3) • Трифторид алюминия (AlF3) • Триэтилалюминий (Al(C2H5)3) • Фосфат алюминия (AlPO4) • Фосфид алюминия (AlP) • Хлорид алюминия (AlCl3)
Соединения бромаБромат калия (KBrO3) • Бромат кальция (Ca(BrO3)2) • Бромат натрия (NaBrO3) • Бромат серебра (AgBrO3) • Бромат стронция (Sr(BrO3)2) • Броматы • Бромид алюминия (AlBr3) • Бромид бора(III) (BBr3) • Бромид диртути(2+) (Hg2Br2) • Бромид магния (MgBr2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромиды • Бромистая кислота (HBrO2) • Бромистоводородная кислота (HBr) • Бромная кислота (HBrO4) • Бромноватая кислота (HBrO3) • Бромноватистая кислота (HBrO) • Бромопентакарбонилрений(I) (Re(CO)5Br) • Броморганические соединения • Гипобромистая кислота (HOBr) • Диоксид брома (BrO2) • Оксид брома (Br2O) • Пербромат калия (KBrO4) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Хлорид брома (BrCl)
Категории:- Соединения алюминия
- Бромиды
- Бинарные соединения
- Галогениды металлов
Wikimedia Foundation. 2010.

![\mathsf{AlBr_3+4H_2O\leftrightarrows[Al(H_2O)_4]^{3+}+3Br^-}](4b4850934f1fecf0f7830b90b164b2f9.png)
![\mathsf{[Al(H_2O)_4]^{3+}+H_2O\leftrightarrows[Al(H_2O)_3(OH)]^{2+}+H_3O^+}](51e539c3c99b08e5edf9857931a76ac0.png)


![\mathsf{AlBr_3+4NaOH=Na[Al(OH)_4]+3NaBr}](411fb48a9f778abdf77899ceb50e49c1.png)



![\mathsf{AlBr_3+4LiH=Li[AlH_4]+3LiBr}](a1ae581c91cd2fb06aba3e5ca5d6683b.png)
![\mathsf{AlBr_3+C_2H_5Br}\rightarrow\mathsf{[C_2H_5]^+[AlBr_4]^-}](451e23f43e27bf26f1f5d4be76e0a970.png)