- Иодид алюминия
-
Иодид алюминия
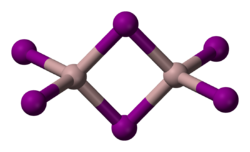
Систематическое название Иодид алюминия
Химическая формула AlI3
Внешний вид кристаллическое вещество белого цвета с желтоватым оттенком
Свойства Молярная масса Температура плавления 188.3 °C (461.45 К)
Температура кипения 382.5 °C (655.65 К)
Плотность 3,98 г/см³
Константа диссоциации pKa 1) 5,02
2) 5,33
3) 5,87
4) 7,50Давление пара 1 мм рт. ст. (178 °C)
10 мм рт. ст. (225 °C)
100 мм рт. ст. (296 °C)Структура Кристаллическая решётка гексагональная
Термодинамические свойства Стандартная энтальпия образования −308 кДж/моль
Энтальпия плавления +15,9 кДж/моль
Стандартная молярная энтропия +190 Дж/(моль·К)
Стандартная энергия образования Гиббса −304 кДж/моль
Классификация Регистрационный номер CAS 7784-23-8
Регистрационный номер EC Безопасность R-фразы R14; R34; R40; R42/43
S-фразы S22; S26; S36/37/39; S45
H-фразы H314; H317
P-фразы P280; P305 + P351 + P338; P310
Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). Иоди́д алюми́ния — неорганическое вещество с химической формулой
 . Относится к классу бинарных соединений, также может рассматриваться как соль алюминия и иодоводородной кислоты. Твердое вещество белого цвета с желтоватым оттенком.
. Относится к классу бинарных соединений, также может рассматриваться как соль алюминия и иодоводородной кислоты. Твердое вещество белого цвета с желтоватым оттенком.Содержание
Физические свойства
Безводный иодид алюминия при нормальных условиях — белое кристаллическое вещество с гексагональной сингонией кристаллической решётки. Плавится и кипит без разложения, гигроскопичен. Образует кристаллогидрат состава
 светло-жёлтого цвета. Кристаллогидрат хорошо растворим в воде, растворим в этаноле, эфире, сероуглероде[1][2].
светло-жёлтого цвета. Кристаллогидрат хорошо растворим в воде, растворим в этаноле, эфире, сероуглероде[1][2].Химические свойства
Иодид алюминия обладает следующими химическими свойствами[1].
- Реагирует с концентрированной серной кислотой:
- При поглощении влаги воздуха частично разлагается с образованием осно́вной соли, та же соль образуется при нагревании кристаллогидрата:
- При нагревании раствора иодида алюминия выпадает осадок гидроксида алюминия:
- В газовой фазе при температуре выше 250 °C происходит частичная димеризация:
- Кроме того, иодид алюминия обладает всеми свойствами, общими для растворимых солей алюминия:
-
- при растворении в воде происходит диссоцииация, сопровождающаяся гидратацией и последующим многоступенчатым гидролизом катиона; при этом создаётся кислотная среда, в частности, для первой ступени гидролиза константа кислотности равна
-
- с разбавленными щелочами образует осадок гидроксида алюминия, с концентрированными разлагается с образованием тетрагидроксоалюмината
Получение
Иодид алюминия может быть получен непосредственно реакцией порошкообразного алюминия и иода (для реакции необходимо небольшое количество воды в качестве катализатора)[1]:
Применение
Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его.Токсичность
Иодид алюминия способен вызывать ожоги кожи и слизистых оболочек (глаз, органов дыхания, ЖКТ). Может вызывать аллергические реакции.
Примечания
- ↑ 1 2 3 Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 20. — 637 с. — ISBN 978-5-358-01303-2
- ↑ Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 76, 442. — 685 с. — ISBN 5-7107-8085-5
Растворимость кислот, оснований и солей в водеH+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? Соединения алюминияАлюминат лития (LiAlO2) • Алюминат натрия (NaAlO2) • Алюмогидрид кальция (Ca[AlH4]2) • Алюмогидрид лития (LiAlH4) • Алюмосиликаты • Антимонид алюминия (AlSb) • Арсенид алюминия (AlAs) • Ацетат алюминия (Al(CH3COO)3) • Бромид алюминия (AlBr3) • Гексафтороалюминат аммония ((NH3)3[AlF6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гидрид алюминия (AlH3) • Гидроксид алюминия (Al(OH)3) • Диборид алюминия (AlB2) • Додекаборид алюминия (AlB12) • Иодид алюминия (AlI3) • Карбид алюминия (Al4C3) • Метагидроксид алюминия (AlO(OH)) • Молибдат алюминия (Al2(MoO4)3) • Монооксид алюминия (AlO) • Монофторид алюминия (AlF) • Монохлорид алюминия (AlCl) • Нитрат алюминия (Al(NO3)3) • Нитрид алюминия (AlN) • Оксид алюминия (Al2O3) • Оксинитрид алюминия (AlON) • Селенид алюминия (Al2Se3) • Силикат алюминия (Al2SiO5) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюминия-калия (KAl(SO4)2) • Сульфид алюминия (Al2S3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоалюминат натрия (Na[AlH4]) • Тетрагидридоалюминат калия (K[AlH4]) • Тетрагидридоалюминат цезия (Cs[AlH4]) • Триизобутилалюминий (Al(C4H9)3) • Триметилалюминий (Al(CH3)3) • Трифенилалюминий (Al(C6H5)3) • Трифторид алюминия (AlF3) • Триэтилалюминий (Al(C2H5)3) • Фосфат алюминия (AlPO4) • Фосфид алюминия (AlP) • Хлорид алюминия (AlCl3)
Категории:- Соединения алюминия
- Бинарные соединения
- Иодиды
- Галогениды металлов
Wikimedia Foundation. 2010.








![K_{a1} = \frac{\mathsf{[Al(H_2O)_5(OH)^{2+}] \ \cdot \ [H_3O^+]}}{\mathsf{[Al(H_2O)_6^{3+}]}} = 9,55 \cdot 10^{-6}](ec5e68407305d2c284ef6a588f9ae3e0.png)

![\mathsf{AlI_3\ +\ 4OH^-\ \longrightarrow\ [Al(OH)_4]^- +\ 3I^-}](ac516b4fcd9114c1a46e618e5d0752e4.png)
