- Е948
-
Кислоро́д / Oxygenium (Oxygen)(O) Атомный номер 8 Внешний вид простого вещества газ без цвета, вкуса и запаха
голубоватая жидкость
(при низких температурах)Свойства атома Атомная масса
(молярная масса)15,9994 а. е. м. (г/моль) Радиус атома 60 (48) пм Энергия ионизации
(первый электрон)1313,1 (13,61) кДж/моль (эВ) Электронная конфигурация [He] 2s² 2p4 Химические свойства Ковалентный радиус 73 пм Радиус иона 132 (-2e) пм Электроотрицательность
(по Полингу)3,44 Электродный потенциал 0 Степени окисления -2, −1, 0 ,+1, +2, -½ Термодинамические свойства простого вещества Плотность 0,00142897 г/см³ Удельная теплоёмкость 0,916 (O-O) Дж/(K·моль) Теплопроводность 0,027 Вт/(м·K) Температура плавления 54,8 K Теплота плавления ?? кДж/моль Температура кипения 90,19 K Теплота испарения 3,4099 кДж/моль кДж/моль Молярный объём 14,0 см³/моль Кристаллическая решётка простого вещества Структура решётки кубическая Период решётки 6,830 Å Отношение c/a n/a Температура Дебая 155 K O 8 15,9994 2s²2p4 Кислород Кислород — химический элемент с атомным номером 8, обозначающийся символом О, а также простое вещество (газ при нормальных условиях), молекула которого состоит из двух атомов кислорода (O2). Кислород является самым лёгким элементом из группы халькогенов (6 группа периодической системы).
Содержание
История открытия
 Схема атома кислорода
Схема атома кислородаОфициально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO (t) → 2Hg + O2↑.
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771-м) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. [Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теории флогистона.]
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке обязано М. В. Ломоносову — это калька термина «оксиген» (фр. l'oxygène), предложенного А. Лавуазье (греческое όξύγενναω от ὀξύς — «кислый» и γενναω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объёму) в воздухе массовая доля кислорода составляет 23,12 % . Элемент кислород входит в состав более 1500 соединений земной коры.
Получение
В настоящее время в промышленности кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной и азотной технологий.При нагревании перманганат калия KMnO4 разлагается до манганата калия K2MnO4 и диоксида марганца MnO2 с одновременным выделением газообразного кислорода O2:
2KMnO4 → K2MnO4 + MnO2 + O2↑
В лабораторных условиях получают также каталитическим разложением пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
Кислород можно также получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + O2↑
Катализатором также выступает MnO2.
 Холодная вода содержит больше растворенного O2
Холодная вода содержит больше растворенного O2Физические свойства
При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объема O2 в 1 объеме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C – 0,03%, при 2600 °C – 1%, 4000 °C – 59%, 6000 °C – 99,5%.
Жидкий кислород (темп. кипения -182,98 °C) это бледно-голубая жидкость.
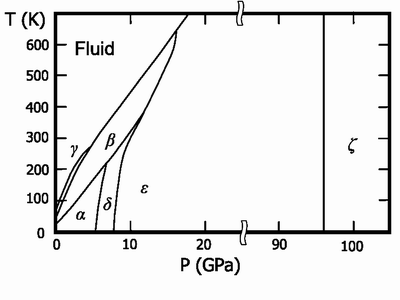
Твердый кислород (темп. плавления -218,79 °C) – синие кристаллы. Известны 6 кристаллических фаз, из которых 3 существуют при давлении в 1 атм.:
- α-О2 температура ниже -249,35 °C, ярко-синие кристаллы, ромбическая сингония, параметры ячейки a=5,50Å, b=3,82Å, c=3,44Å;
- β-О2 температура от -249,35 до -229,35°C, бледно-синие кристаллы, при повышении давления цвет переходит в розовый, ромбоэдрическая сингония, a=6,19Å, α=99°6΄;
- γ-О2 температура от -229.35 до -218,79°C, бледно-синие кристаллы, кубическая сингония, a=6,83Å;
Еще три фазы образуются при высоких давлениях:
- δ-О2 интервал температур до 300 К и давление 6-10 GPa, оранжевые кристаллы;
- ε-О2 давление от 10 и до 96 GPa, цвет кристаллов от темно красного до черного, моноклинная сингония;
- ζ-О2 давление более 96 GPa, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
- Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления -2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
4K + O2 = 2K2O
2Sr + O2 = 2SrO
- окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO + O2 = 2NO2
- окисляет большинство органических соединений:
CH3CH2OH + 3O2 = 2CO2 + 3H2O
- при определенных условиях можно провести «нежное» окисление органического соединения:
CH3CH2OH + O2 = CH3COOH + H2O
- Кислород не окисляет Au и Pt, галогены и инертные газы.
- Кислород образует пероксиды со степенью окисления -1.
- например, пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na + O2 = Na2O2
-
- некоторые окислы поглощают кислород:
2BaO + O2 = 2BaO2
-
- по теории горения, разработанной А. Н. Бахом и Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
H2 + O2 = H2O2
- Надпероксиды имеют степень окисления -1/2, т.е. один электрон на два атома кислорода (ион O2 -). Получают взаимодействием пероксидов с кислородом при повышенных давлениям и температуре:
Na2O2 + O2 = NaO2
- Озониды содержат ион O3 - со степенью окисления -1/3. Получают действием озона на гидроксиды щелочных металлов:
КОН(тв.) + О3 = КО3 + КОН + O2
- Ион диоксигенил O2+ имеет степень окисления +1/2. Получают по реакции:
PtF6 + O2 = O2PtF6
- Фториды кислорода
- Дифторид кислорода, OF2 степень окисления +2, получают пропусканием фтора через раствор щелочи:
2F2 + 2NaOH = OF2 + 2NaF + H2O
-
- Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре -196°С.
- Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
- поддерживает процессы дыхания, горения, гниения
- существует в двух аллотропных модификациях:O2 и O3 (Озон)
Применение
Широкое промышленное применение кислорода началось в середине ХХ века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали связан с применением кислорода.
Сварка и резка металлов
Кислород в баллонах широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Кислород используется для обогащения дыхательных газовых смесей (аэронетики) при нарушении дыхания, для лечения астмы, в виде кислородных коктейлей, кислородных подушек и т. д.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948[1], как пропеллент и упаковочный газ.
Биологическая роль кислорода
Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьезных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее легкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов. А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Имеются радиоактивные изотопы 11О, 13О, 14О (период полураспада 74 сек), 15О (Т1/2=2,1 мин), 19О (Т1/2=29,4 сек), 20О (противоречивые данные по периоду полураспада от 10 мин до 150 лет).
Интересные факты
- Молекулы кислорода при комнатной температуре движутся со сверхзвуковой средней скоростью, составляющей 480 метров в секунду.[2]
См. также
- Категория:Соединения кислорода
- Жидкий кислород
- Озон
Ссылки
Растворимость кислорода в водеMathcad Application Server
- Кислород на Webelements
- Кислород в Популярной библиотеке химических элементов
- Твердый кислород при сверхбольших давлениях: образование молекул О4
- Магнитный коллапс в твердом кислороде
Примечания
- ↑ http://www.food-info.net/uk/e/e948.htm Food-Info.net : E-numbers : E948 : Oxygen
- ↑ Телепортация: прыжок в невозможное / Дэвид Дарлинг. — Москва: Эксмо, 2008. — 300 с. — (Открытия, которые потрясли мир). — 3100 экз.
Wikimedia Foundation. 2010.