- Крик олова
-
О́лово / Stannum (Sn)
Атомный номер 50
Внешний вид простого вещества серебристо-белый мягкий, пластичный металл (β-олово) или серый порошок (α-олово)
Свойства атома Атомная масса
(молярная масса)Радиус атома 162 пм
Энергия ионизации
(первый электрон)Электронная конфигурация [Kr] 4d10 5s2 5p2
Химические свойства Ковалентный радиус 141 пм
Радиус иона (+4e) 71 (+2) 93 пм
Электроотрицательность
(по Полингу)1,96
Электродный потенциал -0,136
Степени окисления +4, +2
Термодинамические свойства простого вещества Плотность Удельная теплоёмкость Теплопроводность Температура плавления 505,1 K
Теплота плавления Температура кипения 2543 K
Теплота испарения Молярный объём Кристаллическая решётка простого вещества Структура решётки тетрагональная
Период решётки 5,820 Å
Отношение c/a n/a
Температура Дебая 170,00 K
Sn 50 118,69 5s²5p² Олово О́лово (лат. Stannum) — химический элемент, расположенный в пятом периоде в IVА группе периодической системы Менделеева; атомный номер 50, атомная масса 118,69; белый блестящий металл, тяжёлый, мягкий и пластичный (в аллотропной модификации β-олово).
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, так как изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисеевой. Олово является (наряду с медью) одним из компонентов бронзы (см. История меди и бронзы), изобретённой в конце или середине III тысячелетия до н. э.. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: 35—11 века до н. э.).
Происхождение названия
Латинское название stannum, связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку этим словом стали называть собственно олово.
Слово олово — общеславянское, имеющее соответствия в балтийских языках (ср. лит. alavas, alvas — «олово», прусск. alwis — «свинец»). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый», лат. albus — «белый» и пр.), так что металл назван по цвету[1].
Нахождение в природе
Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10−4 до 8·10−3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Распространённость в природе
Распространённость в природе отражается в таблице [2]:
Геол. объект Камен. метеориты Дуниты и др. Базальты и др. Диориты и др. Гранитоиды Глины и др. Вода океанов Живое вещество (% на живой вес) Почва Зола растений Содержание, вес. % 1·10−4 5·10−5 1,5·10−4 − 3·10−4 1·10−3 7·10−7 5·10−5 1·10−3 5·10−4 В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на дм³, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³.
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особености его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах [3].
Твёрдая фаза. Минералы
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма; конкретная форма нахождения олова в этом виде не известна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe+2: биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например по схеме Sn+4 + Fe+2 → 2Fe+3. В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2+1Fe+2SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм в месте с Sn выявлены Fe, Al, Cu, Ti, Cd и т. д., не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и др., а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие[4], [5].
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях [5]:
-
-
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана и т. д.; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и т. д.[6].
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и пр.
- Группа осадочных пород различного происхождения.
-
Окисные соединения олова
-
- Наиболее известной формой является главный минерал олова — касситерит SnO2, представляющий собой соединение олова с кислородом. В минерале по данным ядерной гамма-резонансной спектроскопии присутствует Sn+4.
Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зерна минерала достигают в размере 3 — 4 мм и даже больше.
- Плотность 6040-7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твердость 6½.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
-
-
-
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (Приморье), коломорфные и криптокристаллические выделения и скопления (Приморье); кристаллическая форма — главная форма выделения касситерита. В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и др.
-
-
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2+2O [7]; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974;Воронина Л. Б. 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnOxH2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и др.
Силикаты
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5] [8]; пабститом Ba(Sn, Ti)Si3O9 [7], стоказитом Ca2Sn2Si6O18x4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16О32 (Peterson E.U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождения халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде местрождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Независимые исследования выявили аномально высокую растворимость SnO2 в хлор-кремниевых растворах. Максимальная растворимость достигается при отношении
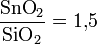 .
.Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2SnkO2k+1, SnkO2k−1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Таким образом, полимеризация молекул Sn(OH)4 и соединение их с молекулами Si(OH)4 ведёт к образованию геля (коллоида) и появлению цепочек HmSn2nSinOp, причём m ≤ 8 [9], или Hs[SiO2n(SnOm)d] (Некрасов И. Я. и др., 1973).
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову (1928—1992) [3]
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
- Ионные соединения. Эти соединения и их структура описываются с позиций классических валентных и стереохимических представлений. Выделяюся подгруппы:
-
- Простые ионы Sn+2 и Sn+4 в основном обнаружены в магматических раславах, а также в гидротермальных растворах, обладающими низкими значениями рН. Однако в существующих гидротермальных системах, отражаемых составом газово-жидких включений, такие условия не установлены.
- Соли галлоидных кислот - SnF2, SnF40, SnCl40. Считается, что роль хлора в переносе и отложении олова и сопутствующих металлов более значительна, чем роль F.
- Гидроксильные соединения олова. В щелочных условиях исходными являются соединения H2SnO2, H2SnO4, H2SnO3. Эти формы часто устанавливаются на основе известных минеральных форм. Часть этих форм имеет как искусственное (CaSnO3, Ca2SnO4), так и природное (FeSnO2, Fe2SnO4) происхождение. В кислых средах эти соединения ведут себя как слабые основания типа Sn(OH)2, Sn(OH)4. Считается, что одной из форм проявления подобных соединений является варламовит. Согласно экспериментальным данным Sn(OH)4 отлагается только при Т< 280°C в слабокислых или нейтральных условиях при рН = 7 - 9. Соединения Sn(OH)4 и Sn(OH)3+ устойчивы при рН= 7 — 9, тогда как Sn(OH)2+2 и Sn(OH)+2 — при рН < 7.
Довольно часто группы (ОН)-1 замещаются на F и Cl, создавая галогенозамещённые модификации гидросоединений олова. В общем виде эти формы представлены соединениями Sn(OH)4-kFk или Sn(OH)4-kFk-nn. В целом соединение Sn(OH)3F устойчиво при Т = 25 — 50 °C, а Sn(OH)2F² при Т = 200 °C.
-
- 4. Сульфидные соединения. По экспериментальным данным в растворе присутствуют соединения SnS4-4 или SnS3-2 при рН > 9; SnS2O-2 (pH = 8 — 9) и Sn(SH)4 (pH = 6). Имеется упоминание о существовании соединения типа Na2SnS3, неустойчивого в кислой среде.
- 2.Комплексные соединения олова изучены при растворении касситерита во фторированных средах. Эти соединения отличаются высокой растворимостью. Этими же свойствами обладают соединения, полученные в хлоридных растворах. В качестве основных форм комплексных соединений, известных из экспериментов, можно назвать Na2[Sn(OH)6], Na2[SnF6], Na2[Sn(OH)2F4] и пр. Эксперименты показали, что комплекс Sn(OH)4F2-2 будет преобладать при Т = 200 °C.
- 3.Коллоидные и олово-кремнистые соединения. Об их существании говорит присутствие на многих месторождениях коломорфных выделений касситерита. Смотреть выше.
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
- А. Формация оловоносных гранитов. Касситерит установлено в акцессорной части гранитов.
- Б. Форрмация редкомеиальных гранитов. Это граниты литионит-амазонит-альбитового типа (апограниты по А. А. Беусу). Касситерит в акцессорной части вместе колумбит-татнатлитом, микролитом и пр.
- В. Формация оловоносных пегматитов. Оловянная минерализация характерна для Be-Li-, Be-Ta-, F-Li- типов.
- Г. Формация полевошпат-кварц-касситеритовая. Выделена Ив. Ф. Григорьевым. Это кварц-полевошпатовые жилы с касситеритом и др. минералами.
- Д.Формация кварц-касстеритовая. Распространена на СВ СССР. Это жильные зоны, грейзены с кварцем, мусковитом, вольфрамитом, касситеритом и др.
- Е.Формация касситерит-силикатно-сульфидная с турмалиновым и хлоритовым типами. Одна из основных продуктивных формаций Приморья России.
- Ж.Формация касситерит-сульфидная. Также основная оловопродуктивная формация. В ней выделяют основные типы:
- штокверковое олово-вольфрамовое оруденение;
- рудные тела квар-касситерит-арсенопиритового типа;
- продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа;
- З.Формация оловянно-скарновая.
- И.Формация деревянистого олова (риолитовая формация).
- К.Формация основных и ультраосновных пород (по И. Я. Некрасову [7], [9])
- Л.Формация щелочных пород Украины(по В. С. Металлиди, 1988).
Добыча
Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Китае, Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Боливии, Перу, Бразилии) и Австралии. В России запасы оловянных руд расположены в Чукотском автономном округе (рудник/посёлок Валькумей, разработка месторождения закрыта в начале 90-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационном методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановления древесного угля, слои которого укладываются поочередно со слоями руды.
Физические и химические свойства
Оловянная чума
При температуре ниже 13,2 °C происходит увеличение удельного объема олова на 25,6 %, и металл образует новую модификацию, обладающую свойствами полупроводников, — олово серое (
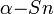 ), в кристаллической решетке которого атомы располагаются менее плотно. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Олово трескается и превращается в порошок. Причем соприкосновение серого олова и белого приводит к «заражению» последнего. Совокупность этих явлений называется «оловянной чумой». Начало научного изучения этого фазового перехода было положено в 1870 г. работами петербургского учёного Ю. Фрицше. Установлено, что это есть процесс аллотропического превращения белого олова в серое со структурой типа алмаза. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии» 1. Белое олово — серебристо-белый, блестящий металл со специфической тетрагональной структурой и электронным s²p²-состоянием — β-фазой (рис. 1). Серое олово — ковалентный кристалл со структурой алмаза и электронным sp³-состоянием — α-фазой. Фазовые переходы олова из белого в серое и обратно сопровождаются перестройкой электронной структуры и сильным (26,6 %) объёмным эффектом. Белое олово можно переохладить до гелиевых температур (температура фазового α-β-равновесия около +13,2 °C). В литературе встречаются указания на то, что олово, попавшее в пробирку, где когда-то находилось способное инфицировать вещество, «заражается»! Показано экспериментально, что если на несколько суток (даже при комнатной температуре) положить на стекло кристалл InSb, то после его удаления «память» о его пребывании там сохраняется. Это стекло «заражает» образец белого олова. Но не сразу, а по прошествии нескольких дней. И не со 100 % вероятностью. С повышением температуры стекла резко возрастает «инкубационный период» и падает вероятность «заражения». Выдержка затравки на стекле при 100 °C полностью устраняет возможность «заражения». Промывание пластины водой, спиртом и другими поглощающими воду веществами также «стирает» эту «память». Потеря «памяти» происходит и в том случае, если затравка находилась в контакте со стеклом в вакууме или в сухом эксикаторе. Существует ещё одно замечательное явление, характерное для «оловянной чумы», — это «память» белого олова о том, что оно когда-то прежде переходило в серое. Ю. Фрицше ещё в 1870 г. заметил, что белое олово, полученное путём нагрева из серого, при повторном охлаждении переходит в серое значительно легче, чем при первом. Образец как бы «вспоминает» свою предысторию, в связи с чем это явление, теперь широко известное, обычно называют «памятью». Коэн к одному из признаков «оловянной чумы» отнёс «порчу» олова после «выздоровления». [10].
), в кристаллической решетке которого атомы располагаются менее плотно. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Олово трескается и превращается в порошок. Причем соприкосновение серого олова и белого приводит к «заражению» последнего. Совокупность этих явлений называется «оловянной чумой». Начало научного изучения этого фазового перехода было положено в 1870 г. работами петербургского учёного Ю. Фрицше. Установлено, что это есть процесс аллотропического превращения белого олова в серое со структурой типа алмаза. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии» 1. Белое олово — серебристо-белый, блестящий металл со специфической тетрагональной структурой и электронным s²p²-состоянием — β-фазой (рис. 1). Серое олово — ковалентный кристалл со структурой алмаза и электронным sp³-состоянием — α-фазой. Фазовые переходы олова из белого в серое и обратно сопровождаются перестройкой электронной структуры и сильным (26,6 %) объёмным эффектом. Белое олово можно переохладить до гелиевых температур (температура фазового α-β-равновесия около +13,2 °C). В литературе встречаются указания на то, что олово, попавшее в пробирку, где когда-то находилось способное инфицировать вещество, «заражается»! Показано экспериментально, что если на несколько суток (даже при комнатной температуре) положить на стекло кристалл InSb, то после его удаления «память» о его пребывании там сохраняется. Это стекло «заражает» образец белого олова. Но не сразу, а по прошествии нескольких дней. И не со 100 % вероятностью. С повышением температуры стекла резко возрастает «инкубационный период» и падает вероятность «заражения». Выдержка затравки на стекле при 100 °C полностью устраняет возможность «заражения». Промывание пластины водой, спиртом и другими поглощающими воду веществами также «стирает» эту «память». Потеря «памяти» происходит и в том случае, если затравка находилась в контакте со стеклом в вакууме или в сухом эксикаторе. Существует ещё одно замечательное явление, характерное для «оловянной чумы», — это «память» белого олова о том, что оно когда-то прежде переходило в серое. Ю. Фрицше ещё в 1870 г. заметил, что белое олово, полученное путём нагрева из серого, при повторном охлаждении переходит в серое значительно легче, чем при первом. Образец как бы «вспоминает» свою предысторию, в связи с чем это явление, теперь широко известное, обычно называют «памятью». Коэн к одному из признаков «оловянной чумы» отнёс «порчу» олова после «выздоровления». [10].«Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 г. Она осталась без горючего из-за того, что оно просочилось через запаянные оловом баки, поражённые «оловянной чумой», названной так в 1911 г. Г. Коэном. Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 г. — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок. «Оловянная чума» погубила многие ценнейшие коллекции оловянных солдатиков. Например, в запасниках питерского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута.
Применение
Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
Цены на металлическое олово в 2006 году составили в среднем 12—18 долл/кг, двуокись олова высокой чистоты около 25 долл/кг, монокристаллическое олово особой чистоты около 210 долл/кг.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Изотопы
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124Sn (5,94 %). Этот элемент обладает наибольшим числом стабильных изотопов, что связано с фактом, что 50 (число протонов в ядрах олова) является магическим числом — оно составлет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра.
Изотопы олова 117Sn и 119Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Физиологическое действие
Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 ºС, не выделяются в воздух рабочей зоны в объёмах, превышающих предельно допустимую концентрацию в соответствии с ГОСТ. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Примечания
- ↑ Л. А. Введенский, Н. П. Колесников. Этимология: Учебное пособие // СПб.: Питер, 2004, стр. 122.
- ↑ Войткевич Г. В., Мирошников А. Е., Поваренных А. С. Краткий справочник по геохимии. М.: Недра, 1970
- ↑ 1 2 Барсуков В. Л. и др. Основные черты геохимии олова. М.: Наука, 1974.
- ↑ Еремеев Н. В. и др. Самородные элементы в лампроидах Центрального Алдана.//Доклады АН СССР, 1988, 303, 6, С.1464 — 1467
- ↑ 1 2 Самородное минералообразование в магматических процессах. Часть I и II. Якутск, 1981
- ↑ Крылова В. В. и др. Олово, свинец и интерметаллические соединения в рудах золото-серебряной формации./Труды ЦНИГРИ, 1979, Т.142, С.22 — 28
- ↑ 1 2 3 Некрасов И. Я. Фазовые соотношения в олово-содержащих системах. М.: Наука, 1976
- ↑ Говоров И. Н. Геохимия рудных районов Приморья. М.: Наука, 1977
- ↑ 1 2 Некрасов И. Я. Олово в магматических и постмагматических процессах. М.: Наука, 1874.
- ↑ Стыркас А. Д. Природа, 1996, № 11[1]
Ссылки
Wikimedia Foundation. 2010.
