- Silicium
-
Кремний/Silicium (Si) Атомный номер 14 Внешний вид простого вещества В аморфной форме —
коричневый порошок,
в кристаллической — тёмно-серый,
слегка блестящийСвойства атома Атомная масса
(молярная масса)28,0855 а. е. м. (г/моль) Радиус атома 132 пм Энергия ионизации
(первый электрон)786,0(8,15) кДж/моль (эВ) Электронная конфигурация [Ne] 3s2 3p2 Химические свойства Ковалентный радиус 111 пм Радиус иона 42 (+4e) 271 (-4e) пм Электроотрицательность
(по Полингу)1,90 Электродный потенциал 0 Степени окисления +4, −4, +2 Термодинамические свойства простого вещества Плотность 2,33 г/см³ Удельная теплоёмкость 19,8 Дж/(K·моль) Теплопроводность 149 Вт/(м·K) Температура плавления 1688 K Теплота плавления 50,6 кДж/моль Температура кипения 2623 K Теплота испарения 383 кДж/моль Молярный объём 12,1 см³/моль Кристаллическая решётка простого вещества Структура решётки алмаз Период решётки 5,430 Å Отношение c/a n/a Температура Дебая 625,00 K Si 14 28,0855 3s²3p² Кремний Содержание
История
 Схема атома кремния
Схема атома кремнияВ чистом виде кре́мний был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Происхождение названия
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российский химиком Германом Ивановичем Гессом. В переводе c греческого kremnos — «утес, гора».
Нахождение в природе
По распространённости в земной коре кремний среди всех элементов занимает второе место (после кислорода). Масса земной коры на 27,6—29,5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Получение
В промышленности кремний получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал[1] — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Физические свойства
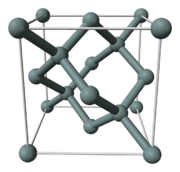 Кристаллическая структура кремния.
Кристаллическая структура кремния.Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению, начиная с длины волны 1.1 микрометр.
 Схематическое изображение зонной структуры кремния [1]
Схематическое изображение зонной структуры кремния [1]Электрофизические свойства
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ [2]. Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·1016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Подвижность электронов 1400 см²/(в*c).
Химические свойства
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Ca2Si + 4HCl → 2CaCl2 + SiH4↑.
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Применение

В настоящее время кремний — основной материал для электроники и солнечной энергетики.
Монокристаллический кремний — материал для зеркал газовых лазеров.
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях.
Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами.
Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, преимущественно применяемый для склеивания бумаги.
Последнее время очень широко применяются полимеры на основе кремния — силиконы.
Биологическая роль
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
См. также
- Категория: Соединения кремния
- Пористый кремний
- Кристаллический кремний
- Германий
- Кремнийорганические соединения
Ссылки
Литература
- Самсонов. Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959. 204 стр. с илл.
- Алёшин Е. П., Алёшин Н. Е. Рис. Москва, 1993. 504 стр. 100 рис.
Примечания
Wikimedia Foundation. 2010.
Silicium — Aluminium ← Silicium → Phosphore C … Wikipédia en Français
SILICIUM — Le silicium (symbole Si, numéro atomique 14) ne se trouve pas à l’état natif, mais constitue, sous forme de silice et de silicates, l’élément le plus abondant (environ 28 p. 100), après l’oxygène, à la surface du globe (cf. SILICATES, SILICE).… … Encyclopédie Universelle
Silicium [1] — Silicium, Atomgew. 28,4, wie Kohlenstoff vierwertig, kommt in der Natur nicht in freiem Zustande vor, dagegen weit verbreitet als Kieselsäure (SiO2), besonders in den Silikaten (s.d.). Man unterscheidet amorphes und kristallisiertes Silicium.… … Lexikon der gesamten Technik
Silicium — Si*lic i*um, n. See {Silicon}. [1913 Webster] … The Collaborative International Dictionary of English
Silicĭum — Silicĭum, so v.w. Kiesel 2). Siliciumfluorid, so v.w. Kieselfluorid, s.u. Kiesel 2) E), vgl. Kieselfluormetalle. Siliciumoxyd, so v.w. Kieseloxyd, s.u. Kiesel 2) A) a). Silieniumwasserstoff, so v.w. Kieselwasserstoff, s.u. Kiesel 2) B) … Pierer's Universal-Lexikon
Silicĭum — (lat.), Kiesel … Meyers Großes Konversations-Lexikon
Silicium [2] — Silicium, Si, Atomgew. 28,3, spez. Gew. des kristallisierten 2,34, des amorphen braunen 2,35, des graphitartigen 2,00. Man gewinnt es neuestens aus Quarzsand und Kohle im elektrischen Ofen als Nebenerzeugnis der Herstellung von Siliciumkarbid… … Lexikon der gesamten Technik
Silicium — Silicium, lat., s. Kieselerde; Silicat, kieselsaures Salz … Herders Conversations-Lexikon
silicium — [sə lish′ē əm, səlis′ē əm] n. [ModL: so named (1808) by DAVY Sir Humphry < L silex, flint (see SILEX) + IUM] former name for SILICON … English World dictionary
Silicium — Eigenschaften … Deutsch Wikipedia
Silicium — Si|li|ci|um 〈n.; s; unz.; chem. ; fachsprachl.〉 = Silizium [zu lat. silex „Kieselstein“] * * * Si|li|ci|um [↑ Silic u. ↑ ium (1)], das; s; Symbol: Si; S: Silizium: chem. Element aus Gruppe 14 des Periodensystems ( … Universal-Lexikon

