- Селен (хим.)
-
Селе́н / Selenium (Se) Атомный номер 34 Внешний вид простого вещества Мягкий неметалл,
похожий на серуСвойства атома Атомная масса
(молярная масса)78,96 а. е. м. (г/моль) Радиус атома 140 пм Энергия ионизации
(первый электрон)940,4 (9,75) кДж/моль (эВ) Электронная конфигурация [Ar] 3d10 4s2 4p4 Химические свойства Ковалентный радиус 116 пм Радиус иона (+6e) 42 (-2e) 191 пм Электроотрицательность
(по Полингу)2,55 Электродный потенциал 0 Степени окисления 6, 4, -2 Термодинамические свойства простого вещества Плотность 4,79 г/см³ Удельная теплоёмкость (Se-Se) 0,321 Дж/(K·моль) Теплопроводность 0,52 Вт/(м·K) Температура плавления 490 K Теплота плавления 5,23 кДж/моль Температура кипения 958,1 K Теплота испарения 59,7 кДж/моль Молярный объём 16,5 см³/моль Кристаллическая решётка простого вещества Структура решётки гексагональная Период решётки 4,360 Å Отношение c/a n/a Температура Дебая n/a K Se 34 78,96 4s2 4p4 Селен Селе́н — химический элемент с атомным номером 34 в периодической системе, обозначается символом Se (лат. Selenium), хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма - киноварно-красная).
Содержание
История
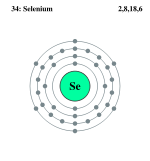 Схема атома селена
Схема атома селенаЭлемент открыт Й. Я. Берцелиусом в 1817.
Сохранился рассказ самого Берцелиуса о том, как произошло это открытие:
Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалюне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты.[1]
Происхождение названия
Название происходит от греч. σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
Получение
Значительные количества селена получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения: окислительный обжиг с возгонкой SeO2; нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO2 с его последующей возгонкой; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементарного селена действием SO2.
Физические свойства
Монокристаллический селен(99,9999 %)Твёрдый селен имеет несколько аллотропных модификаций.Наиболее устойчивой модификацией является серый селен.
Химические свойства
Селен — аналог серы. Так же, как и серу, его можно сжечь на воздухе. Горит синим пламенем, превращаясь в двуокись SeO2. Только SeO2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO2 + H2O → H2SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту H2SeO4, почти такую же сильную, как серная.
Применение
- Одним из важнейших направлений его технологии, добычи, и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. Эта роль селена постоянно растёт, растёт спрос и цены (отсюда дефицит этого элемента).
Цены на селен растут из года в год и в настоящее время колеблются около 120 долларов за 1 кг.
В современной технологии полупроводников применяются селениды многих элементов, например селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
- Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз).
- Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
- В медицине, а также в сельском хозяйстве используют микродобавки селена к лекарственным средствам, витаминным препаратам, БАД, и т. п.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл, Ливерморская национальная лаборатория им. Лоуренса, Ливермор, США).
Биологическая роль
Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина.
Микроэлемент, но большинство соединений достаточно токсично (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях.
Изотопы
В природе существует 6 изотопов селена (74Se, 76Se, 77Se, 78Se, 80Se и 82Se), из них пять, насколько это известно, стабильны, а один (82Se) испытывает двойной бета-распад с периодом полураспада 9,7×1019 лет. Кроме того, искусственно созданы ещё 24 радиоактивных изотопа (а также 9 метастабильных возбуждённых состояний) в диапазоне массовых чисел от 65 до 94.
Периоды полураспада некоторых радиоактивных изотопов селена:
Изотоп Распространённость в природе, % Период полураспада 73Se — 7,1 час. 74Se 0,87 — 75Se — 120,4 сут. 76Se 9,02 — 77Se 7,58 — 77mSe — 17,5 сек. 78Se 23,52 — 79Se — 6,5·104 лет 79mSe — 3,91 мин. 80Se 49,82 — 81Se — 18,6 мин. 81mSe — 62 мин. 82Se 9,19 — 83mSe — 69 сек. 83Se — 25 мин. См. также
- Категория:Соединения селена
- Селеновая кислота
Примечания
- ↑ Цитирование по статье http://www.chemistry.narod.ru/tablici/Elementi/se/Se.htm
Ссылки
Wikimedia Foundation. 2010.

