- Бор-11
-
Бор(B) Атомный номер 5 Внешний вид простого вещества Твёрдый, хрупкий,
блестяще-чёрный. полуметаллСвойства атома Атомная масса
(молярная масса)10.811 а. е. м. (г/моль) Радиус атома 98 пм Энергия ионизации
(первый электрон)800.2(8.29) кДж/моль (эВ) Электронная конфигурация [He] 2s2 2p1 Химические свойства Ковалентный радиус 82 пм Радиус иона 23 (+3e) пм Электроотрицательность
(по Полингу)2.04 Электродный потенциал — Степени окисления 3 Термодинамические свойства простого вещества Плотность 2.34 г/см³ Удельная теплоёмкость 1.025 Дж/(K·моль) Теплопроводность 27.4 Вт/(м·K) Температура плавления 2573 K Теплота плавления 23.60 кДж/моль Температура кипения 3931 K Теплота испарения 504.5 кДж/моль Молярный объём 4.6 см³/моль Кристаллическая решётка простого вещества Структура решётки ромбоэдрическая Период решётки 8.730 Å Отношение c/a 0.576 Температура Дебая 1250.00 K B 5 10,811 2s²2p1 Бор Бор — химический элемент III группы периодической системы, атомный номер 5.
Содержание
История и происхождение названия
Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида
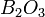 с металлическим калием.
с металлическим калием.Получение
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
1. Метод металлотермии (чаще восстановление магнием или натрием):
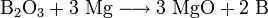
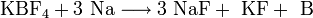
2. Термическое разложение паров бромида бора на раскаленной (1000—1200°С) танталовой проволоке в присутствии водорода:
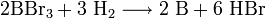
Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химический бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
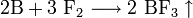 .
.При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
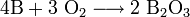
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов с кислотой:
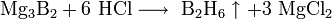
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
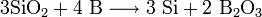
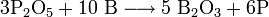
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты
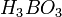 .
.Оксид бора
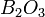 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
— типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты: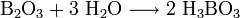
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33-), а тетрабораты, например:
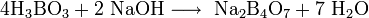
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2-) Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, «не содержащие хлор» («персиль», «персоль» и др.).
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме нитрида углерода, алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода [1]. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике [2].
Борная кислота (H3BO3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде, применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путем изменения ее концентрации в теплоносителе — так называемое «борное регулирование».
Бороводороды и борорганические соединения
Ряд органических производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан(B2H4), пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам, например широко известный пластик Карборан-22.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)•10 – 4 % бора, в костной ткани (1,1—3,3)•10 – 4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г.
Примечания
- ↑ Superconductivity of MgB2: Covalent Bonds Driven Metallic J. M. An and W. E. Pickett Phys. Rev. Lett. 86, 4366 — 4369 (2001)
- ↑ http://arxiv.org/find/all/1/all:+MgB2/0/1/0/all/0/1
Ссылки
Wikimedia Foundation. 2010.
