- Эстеры
-
 Общая формула сложных эфиров карбоновых кислот
Общая формула сложных эфиров карбоновых кислотСложные эфиры — органические соединения, производные карбоновых или минеральных кислот, в которых гидроксильная группа -OH кислотной функции заменена на спиртовой остаток. Отличаются от простых эфиров, в которых два углеводородных радикала соединены атомом кислорода (R1-O-R2).
Содержание
Сложные эфиры карбоновых кислот
В случае эфиров карбоновых кислот выделяются два класса сложных эфиров:
- собственно сложные эфиры карбоновых кислот общей формулы R1-COO-R2, где R1 и R2 — углеводородные радикалы.
- ортоэфиры карбоновых кислот общей формулы R1-C(OR2)3, где R1 и R2 — углеводородные радикалы. Ортоэфиры карбоновых кислот являются функциональными аналогами кеталей и ацеталей общей формулы R-C(OR')2-R" — продуктов присоединения спиртов к карбонильной группе кетонов или альдегидов.
Циклические сложные эфиры оксикислот называются лактонами и выделяются в отдельную группу соединений.
Сложные эфиры минеральных кислот
- Бораты
- Нитраты
- Нитриты
Получение
Основные методы получения сложных эфиров:
- Этерификация — взаимодействие кислот и спиртов в условиях кислого катализа, например получение этилацетата из уксусной кислоты и этилового спирта:
- СН3COOH + C2H5OH = СН3COOC2H5 + H2O
- Частным случаем реакции этерификации является реакция переэтерификации сложных эфиров спиртами, карбоновыми кислотами или другими сложными эфирами:
- R'COOR'' + R'''OH = R'COOR''' + R''OH
- R'COOR'' + R'''COOH = R'''COOR'' + R'COOH
- R'COOR'' + R'''COOR'''' = R'COOR'''' + R'''COOR''
- Реакции этерификации и переэтерификации обратимы, сдвиг равновесия в сторону образования целевых продуктов достигается удалением одного из продуктов из реакционной смеси (чаще всего — отгонкой более летучих спирта, эфира, кислоты или воды; в последнем случае при относительно низких температурах кипения исходных веществ используется отгонка воды в составе азеотропных смесей).
- взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например получение этилацетата из уксусного ангидрида и этилового спирта:
- (CH3CO)2O + 2 C2H5OH = 2 СН3COOC2H5 + H2O
- взаимодействие солей кислот с алкилгалогенидами
- RCOOMe + R'Hal = RCOOR' + MeHal
- Присоединение спиртов к алкенам в условиях кислотного катализа (в том числе и кислотами Льюиса):
- RCOOH + R'CH=CHR'' = RCOOCHR'CH2R''
- Алкоголиз нитрилов в присутствии кислот:
- RCN + H+
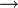 RC+=NH
RC+=NH - RC+=NH + R’OH
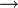 RC(OR')=N+H2
RC(OR')=N+H2 - RC(OR')=N+H2 + H2O
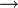 RCOOR' + +NH4
RCOOR' + +NH4
- RCN + H+
Применение и свойства
Сложные эфиры широко используются в качестве растворителей, пластификаторов, ароматизаторов.
- Эфиры муравьиной кислоты
- HCOOCH3 — метилформиат, tкип = 32 °C; растворитель жиров, минеральных и растительных масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида.
- HCOOC2H5 — этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E.
- HCOOCH2CH(CH3)2 — изобутилформиат несколько напоминает запах ягод малины.
- HCOOCH2CH2CH(CH3)2 — изоамилформиат (изопентилформиат) растворитель смол и нитроцеллюлозы.
- HCOOCH2C6H5 — бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как растворитель лаков и красителей.
- HCOOCH2CH2C6H5 — 2-фенилэтилформиат имеет запах хризантем.
- Эфиры уксусной кислоты
- CH3COOCH3 — метилацетат, tкип = 58 °C; по растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель, однако он обладает большей токсичностью, чем ацетон.
- CH3COOC2H5 — этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести).
- CH3COOC3H7 — н-пропилацетат, tкип = 102 °C; по растворяющей способности подобен этилацетату.
- CH3COOCH(CH3)2 — изопропилацетат, tкип = 88 °C; по растворяющим свойствам занимает промежуточное положение между этил- и пропилацетатом.
- CH3COOC5H11 — н-амилацетат (н-пентилацетат), tкип = 148 °C; напоминает по запаху грушу, применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
- CH3COOCH2CH2CH(CH3)2 — изоамилацетат (изопентилацетат) напоминает по запаху бананы.
- CH3COOC8H17 — н-октилацетат имеет запах апельсинов.
- Эфиры масляной кислоты
- C3H7COOCH3 — метилбутират, tкип = 102,5 °C; по запаху напоминает ранет.
- C3H7COOC2H5 — этилбутират, tкип = 121,5 °C; имеет характерный запах ананасов.
- C3H7COOC4H9 — бутилбутират, tкип = 166,4 °C;
- C3H7COOC5H11 — н-амилбутират (н-пентилбутират) и C3H7COOCH2CH2CH(CH3)2 — изоамилбутират (изопентилбутират) имеют запах груш, а также служат растворителями в лаках для ногтей.
- Эфиры изовалериановой кислоты
- (CH3)2CHCH2COOCH2CH2CH(CH3)2 — изоамилизовалерат (изопентилизовалерат) имеет запах яблока.
Применение в медицине
В конце XIX — начале XX века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
См. также
- Триэтилфосфат
- Трибутилфосфат
- Метилформиат
- Этилформиат
- Метилацетат
- Этилацетат
- Пропилацетат
- Бутилацетат
- Амилацетат
- Метилхлорацетат
- Диметилфталат
- Диэтилфталат
- Дибутилфталат
- Диамилфталат
- γ-Бутиролактон
Органические вещества Углеводороды Алканы · Алкены · Алкины · Диены · Циклоалканы · Арены Кислородсодержащие Спирты · Простые эфиры · Альдегиды · Кетоны · Кетены · Карбоновые кислоты · Сложные эфиры · Углеводы · Жиры Азотсодержащие Амины · Амиды · Нитросоединения · Нитрозосоединения · Оксимы · Нитрилы · Аминокислоты · Белки · Пептиды Серосодержащие Меркаптаны · Тиоэфиры · Сульфокислоты · Тиоальдегиды · Тиокетоны · Тиокарбоновые кислоты Фосфорсодержащие Фосфины · Фосфонистые кислоты · Фосфиновые кислоты · Фосфоновые кислоты · Нуклеиновые кислоты · Нуклеотиды Кремнийорганические Силаны · Силазаны · Силтианы · Силоксаны · Силиконы Элементоорганические Германийорганические · Борорганические · Оловоорганические · Свинецорганические · Алюминийорганические · Ртутьорганические · Другие металлоорганические Другие важные классы Галогенуглеводороды · Гетероциклические соединения · Перфторуглеводороды
Wikimedia Foundation. 2010.
