- Антраниловая кислота
-
Антраниловая кислота — ароматическая аминокислота. Производные антраниловой кислоты применяются в производстве красителей и синтетических душистых веществ.
АНТРАНИЛОВАЯ КИСЛОТА (о-аминобензойная кислота) NH2C6H4COOH, мол. м. 137,14; бесцветные кристаллы; температура плавления 145 °C; возгоняется. Растворимость (г в 100 г растворителя): в воде - 0,35 (14 °C), 90%-ном этаноле - 10,7 (9,6 °C), бензоле - 1,8 (12 °C), эфире - 16 (6,8 °C); хорошо растворима в горячих хлороформе, этаноле, пиридине. Антраниловая кислота амфотерна lgK1 = 5 , lgK2= 12). Нижний концентрационный предел воспламенения 44 г/м3, температура воспламенения 100 °C.
Соли А.к. со щелочными металлами, а также минеральными кислотами хорошо растворимы в воде; растворы обладают голубой флуоресценцией. При перегонке А. к. декарбоксилируется до анилина. Она образует с Cd, Со, Cu (II), Ni, Zn, Pb и Hg в уксуснокислых растворах (рН 2,5-5) внутрикомплексные малорастворимые соединения, что используется для гравиметрического определения перечисленных элементов. Диазотирование Антраниловой кислоты приводит к о-диазобензойной кислоте (является внутренней солью), которая при УФ-облучении образует дегидробензол.
Содержание
Качественные реакции на определение
Цветные реакции на А. к.:
С солями Cu(II) в уксуснокислой среде образует ярко-зеленый осадок (м-аминобензойная кислот дает голубое окрашивание); в отличие от м- и n-аминобензойных кислот, при сплавлении А. к. с небольшим избытком SnCl4 и обработке охлажденного плава водным раствором спирта появляется фуксино-красная окраска.
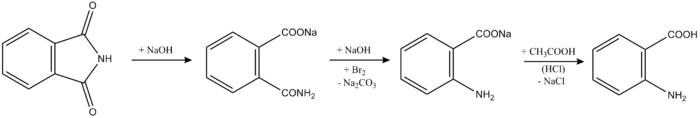
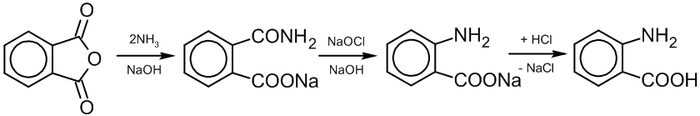
Получение
В промышленности А. к. получают: 1) действием водного раствора NH3 на фталевый ангидрид (рН 7,5-8,5; 40 °C) и последующим взаимодействием полученной Na-соли фталаминовой кислоты с раствором NaOCl при 60 °C (расщепление по Гофману): 2) действием на щелочной раствор фталимида NaOCl или NaOBr. К-ту выделяют разб. HCl (40-50 °C); выход 84%. Процесс может быть осуществлен периодическим или непрерывным способом.
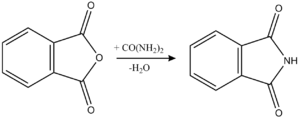
Лабораторный метод синтеза
Получения фталимида
Нагревают смесь, состоящую из 7,5г тонко измельченного фталевого ангидрида и 3г мочевины, в колбе на 100 мЛ на воздушной бане при температуре 130-135 °C. Реакция начинается в вспениванием (термометр в расплаве), причем температура поднимается до 160 °C. По окончании реакции получают твёрдую пористую массу, которую, с прибавлением небольшого кол-во воды, размельчают и отфильтровывают на воронке Бюхнера. Осадок хорошо отжимают на фильтре и сушат. Выход 6г.
Получения антраниловой кислоты (с использованием перегруппировки Гофмана)
В фарфоровый стакан на 100 мЛ помещают раствор 8г едкого натра в 40 мЛ воды и охлаждают до −5 °C. При перемешивании к нему приливают 2 мЛ брома, а затем суспензию 6г фталимида в 8 мЛ воды. После этого охладительную смесь удаляют и реакционную массу оставляют при комнатной температуре периодически перемешивая. Когда температура реакционной смеси достигает 15-20 °C, вносят 4,8г твердого едкого натра, измельченного в порошок и нагревают до 80 °C. Горячий раствор фильтруют через складчатый фильтр и после охлаждения раствор нейтрализуют 12,8 мЛ концентрированной соляной кислотой. Антраниловую кислоту осаждают 6 мЛ ледяной уксусной кислоты и оставляют не менее чем на 2 часа кристаллизоваться. Подкисление реакционной смеси следует проводить осторожно, т.к. происходит сильное вспенивание при нейтрализации образовавшейся в реакции соды. Выпавшую антраниловую кислоту отсасывают на воронке Бюхнера, промывают холодной водой и сушат на воздухе. Выход 4,8г. Тпл=144 °C.
Применение
Промежуточный продукт при синтезе индиго и других азокрасителей. Производные применяют в производстве азокрасителей и душистых веществ. Для парфюмерии наиболее важны эфиры NH2C6H4COOR - метилантранилат (R = CH3; температура плавления 24-25 °C, температура кипения 132 °C/14 мм рт. ст.) и этилантранилат (R = С2Н5; жидкость, температура кипения 138 °C/14 мм рт.ст.), имеющие запах цветов апельсинового дерева.
Антраниловой кислотой при рафинации хлопкового масла высаживают токсичный полифенол госсипол, присутствие которого препятствует употреблению данного масла в пищу.
Ссылки
Химическая Энциклопедия. Т. 1., Гл. ред. И.Л. Кнунянц. - М.: Советская энциклопедия, 1988
Дополнительная литература
Белов В И, Химия и технология душистых веществ, М., 1976
Петрова Р.А., Потапова Т.И. — Многостадийные синтезы. Методические указания для лабораторного практикума по органической химии
Ullmanns Encyklopadie, 4 Aufl., Bd. 8, Weinheim, 1974, S. 374-75
Витамины (АТХ: ) Жирорастворимые витамины Ретинол (A1) · Дегидроретинол (A2) · Ламистерол (D1) · Эргокальциферол (D2) · Холекальциферол (D3) · Дигидротахистерол (D4) · 7-дегидротахистерол (D5) · α-, β-, γ-токоферолы (E) · Филлохинон (K1) · Менатетренон (K2) · Менадион (K3) · Менадиол (K4) · Триглицериды жирных кислот Омега-3 и Омега-6 (F) Водорастворимые витамины Тиамин (B1) · Рибофлавин (B2) · Никотиновая кислота, Никотинамид (PP) · Холин (Β4) · Пантотеновая кислота · Пиридоксин (B6) · Биотин (B7, H) · Инозитол (B8) · Фолиевая кислота (B9, Bc, M) · Пара-аминобензойная кислота (B10, H1, ПАБК) · Левокарнитин (B11, BT, O) · Цианокобаламин (B12) · Оротовая кислота (B13) · Пангамовая кислота (B15) · Аскорбиновая кислота (C) · Тиоктовая кислота (N) · Биофлавоноиды (P) · S-метилметионин (U) Витаминоподобные вещества Бенфотиамин · Аденин · Флавин (J) · Антраниловая кислота (L1) · Декспантенол Антивитамины Дикумарол · Варфарин · Пиритиамин · Изониазид · Циклосерин · Мепакрин (акрихин) · Тиаминаза · Аскорбатоксидаза · Категории:- Аминокислоты
- Прекурсоры, оборот которых ограничен в РФ (Список IV)
Wikimedia Foundation. 2010.