- Предельные углеводороды
-
Эта статья — о химических соединениях. Статью о канадской алюминиевой компании Alcan см. ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными соединениями и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. Простейшим представителем класса является метан (CH4).
Содержание
Номенклатура
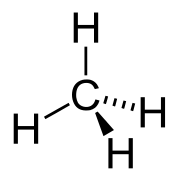 Химическая структура метана, простейшего алкана
Химическая структура метана, простейшего алканаРациональная
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название алкил1алкил2алкил3алкил4метан, например:
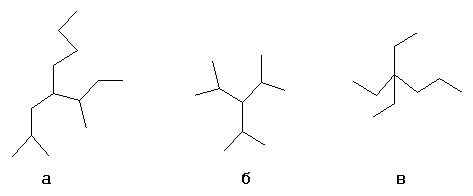
- а- н-бутил-втор-бутил-изобутилметан
- б- триизопропилметан
- в- триэтил-пропилметан
Систематическая ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. Если радикалы не одинаковые, то их названия перечисляются в алфавитном порядке. Например:
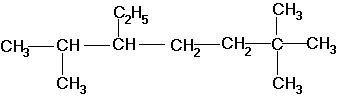
2,6,6-триметил-3-этилгептан
Гомологический ряд и изомерия
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода. Для алканов с n = 1..12 число изомеров равно 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355
Гомологический ряд алканов (первые 10 членов) Метан CH4 CH4 Этан CH3—CH3 C2H6 Пропан CH3—CH2—CH3 C3H8 н-Бутан CH3—CH2—CH2—CH3 C4H10 н-Пентан CH3—CH2—CH2—CH2—CH3 C5H12 н-Гексан CH3—CH2—CH2—CH2—CH2—CH3 C6H14 н-Гептан CH3—CH2—CH2—CH2—CH2—CH2—CH3 C7H16 н-Октан CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 C8H18 н-Нонан CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 C9H20 н-Декан CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 C10H22 Физические свойства
- Температура плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях алканы с CH4 до C4H10 — газы; с C5H12 до C17H36 — жидкости. И после C18H38 — твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так например, при нормальних условиях н-пентан жидкость, а неопентан — газ.
Физические свойства нормальных алканов n Название Ткип Тпл Плотность Показатель преломления 1 Метан −164 −182,48 0,466 (-452324) - 2 Этан −88,63 −183,3 0,546 - 3 Пропан −42,1 −189,7 0,5853 (-45) - 4 Бутан −0,5 −138,35 0,5788 1,3326 4а Изобутан −11,73 −159,60 0,5510 1,3508 5 Пентан 36,1 −130 0,626 1,3575 6 Гексан 68,7 −95 0,659 1,3749 7 Гептан 98,4 −91 0,684 1,3876 8 Октан 125,7 −57 0,703 1,3974 9 Нонан 150,8 −54 0,718 1,4054 10 Декан 174,1 −30 0,730 1,4119 11 Ундекан 195,9 −25,6 12 Додекан 216,3 −9,7 13 Тридекан 235,5 −6,0 14 Тетрадекан 253,6 5,5 15 Пентадекан 270,7 10 16 Гексадекан 287,1 18,1 17 Гептадекан 302,6 22 18 Октадекан 317,4 28 19 Нонадекан 331,6 32 20 Эйкозан 345,1 36,4 21 Генэйкозан 215 (15 мм рт ст) 40,4 22 Докозан 224,5 (15 мм рт ст) 44,4 23 Трикозан 234 (15 мм рт ст) 47,4 24 Тетракозан 243 (15 мм рт ст) 51,1 25 Пентакозан 259 (15 мм рт ст) 53,3 26 Гексакозан 262 (15 мм рт ст) 57 27 Гептакозан 270 (15 мм рт ст) 60 28 Октакозан 280 (15 мм рт ст) 61,1 29 Нонакозан 286 (15 мм рт ст) 64 30 Триаконтан 304 (15 мм рт ст) 66 40 Тетраконтан — 81,4 50 Пентаконтан 421 92,1 60 Гексаконтан — 98,9 70 Гептаконтан — 105,3 100 Гектан — 115,2 Спектральные свойства
ИК-спектроскопия
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С-Н в области 2850-3000 см-1. Частоты валентных колебаний связи С-С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С-Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см-1, однако метильная группа дает в спектрах слабую полосу при 1380 см-1.
УФ-спектроскопия
Чистые алканы не поглощают в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
ЯМР-спектроскопия
Масс-спектрометрия
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь(в зависимости от нехватки кислорода)
В общем случае уравнение реакции горения для любого углеводорода CxHy, можно записать в следующем виде:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем).
Нитрование
Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH + HNO3 = RNO2 + H2O Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450°С и низком давлении — 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана: CH4→С+2H2 — при 1000 °C
Частичный крекинг: 2CH4→C2H2+3H2 (Ацетилен) — при 1500 °C
Получение
Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
Восстановление спиртов
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода.
H3C−CH2−CH2−CH2OH→H3C−CH2−CH2−CH3
Восстановление карбонильных соединений
Гидрирование непредельных углеводородов
- Из алкенов
CnH2n+H2→CnH2n+2
- Из алкинов
CnH2n-2+2H2→CnH2n+2
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO- перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R-R. Например:
2CH3COO- — 2e → 2[CH3COO•] → 2CH3• → C2H6
2C3H7COOK →{электролиз}→ C6H14
Газификация твердого топлива
Проходит при повышенной температуре и давлении. Катализатор Ni:
C+2H2→CH4
Реакция Вюрца
2R-Br + 2Na = R-R + 2NaBr
реакция идёт в ТГФ при температуре −80 °C.
при взаимодействии R и R` возможно образование смеси продуктов (R-R, R`-R`, R-R`)Синтез Фишера-Тропша
nCO + (2n+1)H2→CnH2n+2 + H2O
Биологическое действие
Обладают наркотическим действием, которое возрастает с увеличением числа атомов углерода. При хроническом действии нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов.
Литература
- Общая токсикология / под ред. А. О. Лойта. Спб.: ЭЛБИ-СПб., 2006
Ссылки
Углеводороды Алканы Метан · Этан · Пропан · Бутан · Пентан · Гексан · Гептан · Октан · Нонан · Декан · Ундекан · Додекан · Гексадекан Алкены Этилен · Пропилен · Бутилен · Изобутилен Алкины Ацетилен · Пропин · Бутин · Диацетилен Диены Бутадиен · Изопрен Другие ненасыщеные Винилацетилен Циклоалканы Циклопентан · Циклогексан · Декалин · Индан Ароматические Бензол · Толуол · Ксилол · Этилбензол · Кумол · Стирол · Фенилацетилен · Индан · Циклобутадиен Полиароматические Дифенил · Терфенил · Дифенилметан · Трифенилметан Конденсированные Нафталин · Антрацен · Фенантрен · Бензпирен · Азулен Органические вещества Углеводороды Алканы · Алкены · Алкины · Диены · Циклоалканы · Арены Кислородсодержащие Спирты · Простые эфиры · Альдегиды · Кетоны · Кетены · Карбоновые кислоты · Сложные эфиры · Углеводы · Жиры Азотсодержащие Амины · Амиды · Нитросоединения · Нитрозосоединения · Оксимы · Нитрилы · Аминокислоты · Белки · Пептиды Серосодержащие Меркаптаны · Тиоэфиры · Сульфокислоты · Тиоальдегиды · Тиокетоны · Тиокарбоновые кислоты Фосфорсодержащие Фосфины · Фосфонистые кислоты · Фосфиновые кислоты · Фосфоновые кислоты · Нуклеиновые кислоты · Нуклеотиды Кремнийорганические Силаны · Силазаны · Силтианы · Силоксаны · Силиконы Элементоорганические Германийорганические · Борорганические · Оловоорганические · Свинецорганические · Алюминийорганические · Ртутьорганические · Другие металлоорганические Другие важные классы Галогенуглеводороды · Гетероциклические соединения · Перфторуглеводороды
Wikimedia Foundation. 2010.
