- Хлорид цезия
-
Хлорид цезия 

Общие Систематическое наименование Хлорид цезия Традиционные названия Хлорид цезия Химическая формула CsCl Эмпирическая формула CsCl Физические свойства Состояние (ст. усл.) твёрдое Примеси Rb, Ca, Na Молярная масса 168,36 г/моль Плотность 3,983[1] г/см³ Термические свойства Температура плавления 646[1] °C Температура кипения 1295[1] °C Молярная теплоёмкость (ст. усл.) 52,63[2] Дж/(моль·К) Энтальпия образования (ст. усл.) −443[1] кДж/моль Химические свойства Растворимость в воде 186,5[1] г/100 мл Оптические свойства Показатель преломления 1,6418[3] Структура Кристаллическая структура кубическая объёмноцентрированная Дипольный момент 10,42 Д Классификация Рег. номер CAS 7647-17-8 Регистрационный номер EC 231-600-2 RTECS FK9625000 Безопасность ЛД50 1500[4] мг/кг Хлори́д це́зия (цезий хлористый), CsCl — неорганическое бинарное соединение цезия с хлором, цезиевая соль хлороводородной кислоты. В кристаллическом состоянии — бесцветное вещество с ионной структурой; нелетучее, термически устойчивое. Хлорид цезия хорошо растворим в воде и концентрированной соляной кислоте.
Встречается в природе в виде примеси к минералу карналлиту (до 0,002 %)[5], сильвину и каиниту[6]:[стр. 210—211]. Также содержится в небольших количествах в минеральных водах. Например, в Дюркхеймском минеральном источнике (Германия), где и был впервые обнаружен цезий, содержание CsCl достигает 0,17 мг/л[6]:[стр. 206].
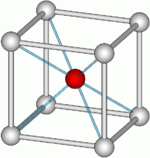
Кристаллическая структура CsCl выбрана в качестве типовой кубической объемноцентрированной кристаллической решётки для соединений вида AX (тип CsCl), где центральный атом A (Cs) окружён восемью атомами (группами атомов) X (Cl).
В 1905 году французский химик Акспиль (фр. Hackspill) выделил металлический цезий восстановлением хлорида цезия кальцием в вакууме[7]. Этот метод до сих пор остаётся наиболее распространённым способом промышленного получения цезия[8].
Содержание
Молекулярная и кристаллическая структура
Хлорид цезия — соединение с ярко выраженной ионной структурой (ионный кристалл), в которой каждый ион цезия Cs+ окружен восемью ионами хлора Cl−[9]. Дипольный момент молекулы составляет 10,42 Д[1]:[стр. 377]. Энергия атомизации (Eсв) равна 443 кДж/моль, длина связи (межъядерное расстояние между атомами) — 291 пм[1]:[стр. 380]. Энергия сродства к электрону 0,445 эВ[10]:[стр. 10-150]. Вторичная электронная эмиссия, δмакс = 6,5[10]:[стр. 12-125]. Элементный состав соединения: Cs 78,94 %, Cl 21,06 %. Хлорид цезия в газообразном состоянии содержит молекулы димера Cs2Cl2 плоской ромбической формы[11].
Кристаллическая решётка соединения кубическая (α-CsCl), кристаллографическая группа (221) Pm3m Oh1. Расстояние между соседними плоскостями решётки d = 0,411 нм[2]:[стр. 199].
Показатель преломления у кристаллического CsCl при различной длине волны[10]:[стр. 10-227]:
Длина волны, нм 300 589 750 1000 2000 5000 10000 20000 Показатель преломления 1,712 1,640 1,631 1,626 1,620 1,616 1,606 1,563 Числа Аббе для хлорида цезия: Vd = 43,92; Ve = 43,58[12].
При нагревании выше 454 °С α-CsCl переходит в гранецентрированную модификацию β-CsCl[6]:[стр. 96]. Энергия кристаллической структуры (U) составляет 650,7 кДж/моль[13].
Физические свойства
Хлорид цезия в нормальных условиях представляет собой бесцветное (в крупно-кристаллическом виде) или белое (в виде порошка) соединение, хорошо растворимое в воде (186,5 грамм CsCl в 100 г H2O при 20 °С, 250 г при 80 °С, 270,5 г при 100 °С)[1]:[стр. 620][3]. Гигроскопичен, на воздухе расплывается; более летуч, чем хлорид калия[14]. Не образует кристаллогидратов[15].
Зависимость растворимости хлорида цезия (в массовых процентах) в воде от температуры[10]:[стр. 8-112]:
Температура 0 °С 10 °С 20 °С 25 °С 30 °С 40 °С 50 °С 60 °С 70 °С 80 °С 90 °С 100 °С Растворимость, % 61,83 63,48 64,96 65,64 66,29 67,50 68,60 69,61 70,54 71,40 72,21 72,96 Растворимость в некоторых неводных неорганических средах[16]:
- в диоксиде серы при 25 °С: 0,295 грамм/100 г растворителя;
- в аммиаке при 0 °С: 0,38 грамм/100 г растворителя.
Растворим в метаноле, малорастворим в этаноле (3,17 и 0,76 грамм CsCl в 100 г растворителя соответственно при 25 °С); хорошо растворим в муравьиной кислоте (107,7 грамм CsCl в 100 г растворителя при 18 °С) и гидразине[6]:[стр. 97][15][17].
Зависимость растворимости хлорида цезия (в граммах на 100 г растворителя) в метаноле и этаноле от температуры[К 1][16]:
Температура 0 °С 15 °С 25 °С 40 °С 50 °С 60 °С метанол 2,37 2,93 3,16 3,45 3,53 н/д этанол 0,483 0,626 0,757 0,840 0,968 0,919 Плохо растворим в ацетоне (0,004 % при 18 °С) и ацетонитриле (0,0083 грамм в 100 г растворителя при 18 °С)[17]. Практически не растворим в этилацетате и других сложных эфирах, метилэтилкетоне, ацетофеноне, пиридине, хлорбензоле[18].
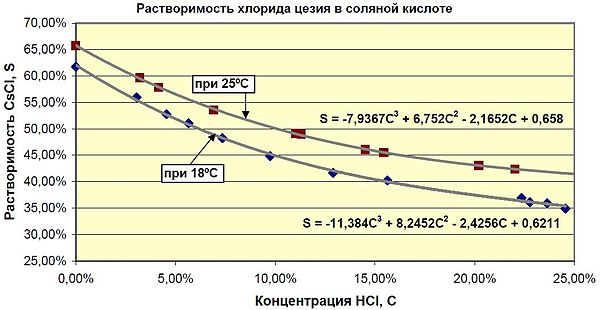
В отличие от NaCl и KCl хорошо растворяется в концентрированной соляной кислоте[11]. Ниже представлен график зависимости растворимости хлорида цезия от температуры и концентрации HCl[17].
Плотность водного раствора CsCl при 20 °C[1]:[стр. 645]:
1 % 2 % 4 % 6 % 8 % 10 % 12 % 14 % 16 % Плотность, г/л 1005,9 1013,7 1029,6 1046,1 1062,9 1080,4 1098,3 1116,8 1135,8 18 % 20 % 22 % 24 % 30 % 35 % 40 % 50 % 60 % 1155,5 1175,8 1196,8 1218,5 1288,2 1352,2 1422,5 1585,8 1788,6 Коэффициенты активности для водных растворов CsCl различной концентрации при 25 °С[10]:[стр. 5-95]:
Моляльность, моль/кг 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 Коэффициент активности 0,756 0,694 0,656 0,628 0,606 0,589 0,575 0,563 0,553 0,544 Некоторые физические параметры водных растворов CsCl при 20 °C[10]:[стр. 8-61,62]:
Физические параметры водных растворов CsCl при 20 °C Массовая концентрация, % Моляльность, моль/кг Молярность, моль/л Показатель преломления[К 2] Понижение температуры замерзания, °С[К 3] Динамическая вязкость, 10−³ Па·с 0,5 0,030 0,030 1,3334 0,10 1,000 1,0 0,060 0,060 1,3337 0,20 0,997 2,0 0,121 0,120 1,3345 0,40 0,992 3,0 0,184 0,182 1,3353 0,61 0,988 4,0 0,247 0,245 1,3361 0,81 0,984 5,0 0,313 0,308 1,3369 1,02 0,980 6,0 0,379 0,373 1,3377 1,22 0,977 7,0 0,447 0,438 1,3386 1,43 0,974 8,0 0,516 0,505 1,3394 1,64 0,971 9,0 0,587 0,573 1,3403 1,85 0,969 10,0 0,660 0,641 1,3412 2,06 0,966 12,0 0,810 0,782 1,3430 2,51 0,961 14,0 0,967 0,928 1,3448 2,97 0,955 16,0 1,131 1,079 1,3468 3,46 0,950 18,0 1,304 1,235 1,3487 3,96 0,945 20,0 1,485 1,397 1,3507 4,49 0,939 22,0 1,675 1,564 1,3528 н/д 0,934 24,0 1,876 1,737 1,3550 н/д 0,930 26,0 2,087 1,917 1,3572 н/д 0,926 28,0 2,310 2,103 1,3594 н/д 0,924 30,0 2,546 2,296 1,3617 н/д 0,922 32,0 2,795 2,497 1,3641 н/д 0,922 34,0 3,060 2,705 1,3666 н/д 0,924 36,0 3,341 2,921 1,3691 н/д 0,926 38,0 3,640 3,146 1,3717 н/д 0,930 40,0 3,960 3,380 1,3744 н/д 0,934 42,0 4,301 3,624 1,3771 н/д 0,940 44,0 4,667 3,877 1,3800 н/д 0,947 46,0 5,060 4,142 1,3829 н/д 0,956 48,0 5,483 4,418 1,3860 н/д 0,967 50,0 5,940 4,706 1,3892 н/д 0,981 60,0 8,910 6,368 1,4076 н/д 1,120 64,0 10,560 7,163 1,4167 н/д 1,238 Эмпирическая зависимость растворимости хлорида цезия (m, моль/кг) в воде от давления (P, МПа; в диапазоне от 0,10 до 400 МПа) и температуры (T, K; в диапазоне 273—313 K) выражается следующим уравнением (среднеквадратическое отклонение: 0,022 моль/кг)[19]:

Основные термодинамические характеристики[1]:[стр. 462, 532]:
в газообразном состоянии:
- стандартная энтальпия образования, ΔHo298 = −245 кДж/моль;
- стандартная энтропия, So298 = 256 Дж/(моль·K);
- стандартная энергия Гиббса образования, ΔGo298 = −263 кДж/моль.
в кристаллическом состоянии (α):
- стандартная энтальпия образования, ΔHo298 = −443 кДж/моль;
- стандартная энтропия, So298 = 101 Дж/(моль·K);
- стандартная энергия Гиббса образования, ΔGo298 = −415 кДж/моль.
характеристики фазовых переходов:
- температура перехода α-CsCl → β-CsCl = 742,5 K;
- температура перехода β-CsCl → CsCl(жидкий) = 918 K;
- температура перехода CsCl(жидкий) → CsCl(газ) = 1575 K;
- энтальпия перехода α-CsCl → β-CsCl, ΔHo = 2,43 кДж/моль;
- энтальпия перехода β-CsCl → CsCl(жидкий), ΔHo = 20,75 кДж/моль;
- энтальпия перехода CsCl(жидкий) → CsCl(газ), ΔHo = 149,33 кДж/моль;
- энтропия перехода α-CsCl → β-CsCl, ΔSo = 3,31 кДж/(моль·K);
- энтропия перехода β-CsCl → CsCl(жидкий), ΔSo = 22,59 кДж/(моль·K).
Давление насыщенных паров хлорида цезия описывается следующими уравнениями[20]:






где p — давление, мм рт. ст.; T — температура, K.
Некоторые физические константы хлорида цезия:
- плотность, ρ = 3,988 г/см³[К 1][10]:[стр. 4-51];
- плотность при температуре плавления, ρпл = 2,79 г/см³[10]:[стр. 4-126];
- энтальпия растворения в воде, Δр-рHo298 = 17,78 кДж/моль[10]:[стр. 5-103];
- средняя изобарная теплоёмкость, Cop, 298 K = 52,63 Дж/(моль·K)[2]:[стр. 76],
Cp, 298—500 K = 53,6 Дж/(моль·K)[2]:[стр. 58]; - относительная диэлектрическая проницаемость, ε = 7,2[К 4][21];
- удельная электрическая проводимость, G = 114 См/м (при 660 °С),
126 См/м (при 711 °С), 139 См/м (при 775 °С), 148 См/м (при 831 °С)[22]; - молярная магнитная восприимчивость, χm = −56,7×106 см³/моль[10]:[стр. 4-144];
Уравнение зависимости теплоёмкости от температуры (T) в диапазоне 298—918 K[2]:[стр. 76]:

Эмпирическая зависимость для коэффициента самодиффузии от температуры (T) выражается следующим уравнением[23]:

где Do — фактор диффузии, см2/с; Ea — энергия активации, кДж/моль; R — универсальная газовая постоянная.
Значения Do и Ea для иона Cs+ в кристалле CsCl[23]:
- T: 630—730 K; Do=1,1; Ea=130;
- T: 760—880 K; Do=0,1; Ea=134.
Значения Do и Ea для иона Cl− в кристалле CsCl[23]:
- T: 550—730 K; Do=1,51; Ea=122;
- T: 760—880 K; Do=0,7; Ea=152.
Значения Do и Ea для диффузии инертного газа (Xe) в кристалле CsCl[23]:
- T: 620—740 K; Do=0,1; Ea=86,6;
- T: 740—920 K; Do=0,1; Ea=83,5.
Получение
В лабораторных условиях хлорид цезия может быть получен взаимодействием гидроксида, карбоната, гидрокарбоната или сульфида цезия с соляной кислотой:
 Поллуцит — сырьё для производства CsCl.
Поллуцит — сырьё для производства CsCl.
В промышленности хлорид цезия получают переработкой рудного сырья, как правило, поллуцита — основного промышленного минерала цезия. Основной способ вскрытия измельчённого поллуцитового концентрата — обработка его соляной кислотой при повышенной температуре[К 5][24]:
Выделение хлорида цезия из раствора осуществляют с помощью его осаждения в виде нерастворимых двойных солей, используя хлорид сурьмы(III), монохлорид иода или хлорид церия(IV)[24]:
После отделения и очистки осадка хлорид цезия отделяют от побочного продукта с помощью термического гидролиза или осаждением с помощью сероводорода — в обеих случаях CsCl остаётся в растворе[24]:
Для получения особо чистого хлорида цезия используют его осаждение в виде Cs[I(Cl)2] или Cs[I(Cl)4] с последующей перекристаллизацией из солянокислого раствора. Собственно CsCl получают из комплексной соли термически[6]:[стр. 357—358]:
Также сырьём для получения хлорида цезия являются отходы переработки карналлита[6]:[стр. 307—314]. В России промышленное производство соединения осуществляется на единственном предприятии — ЗАО «Завод редких металлов» (г. Новосибирск)[25].
Несмотря на достаточно большой спектр направлений использования соединения (см. раздел Применение), ежегодный мировой объём производства товарного хлорида цезия[К 6] очень небольшой. По данным на 2010 год, он составляет менее 20 тонн[26].
Химические свойства
Хлорид цезия при растворении в воде практически полностью диссоциирует на ионы, при этом в разбавленном растворе катионы цезия сольватированы[27]:
В водных растворах вступает в типичные реакции обмена с некоторыми соединениями:
Твёрдый CsCl при нагревании с концентрированной серной кислотой (кипячение) или гидросульфатом цезия (550—700 °С) образует сульфат[27]:
Очень слабый восстановитель, окисляется до хлора только с помощью сильных окислителей в жёстких условиях[27]:
С некоторыми хлоридами образует смешанные соли: 2CsCl • BaCl2[28], 2CsCl • CuCl2, CsCl • 2CuCl, CsCl • LiCl и ряд других[29].
Вступает в реакцию с межгалогенными соединениями, образуя полигалогениды[30]:
Применение
Хлорид цезия образуется как полупродукт при извлечении цезия из минерального сырья[31], а также как сырьё для металлотермического получения самого металла[5]:
Соединение используют для получения гидроксида цезия — электролизом водного раствора соли[6]:[стр. 90]:
Соединение было использовано для изучения ионов менделевия Md+[32].
В радиоэлектронной промышленности хлорид цезия используется в вакуумных трубках для радио- и телеаппаратуры, производства рентгенофлуоресцентных экранов; в радиографии в качестве контрастного вещества[33].
Важным направлением использования CsCl является его применение в качестве рабочего раствора для ультрацентрифугирования белковых частиц в градиенте плотности. В методе равновесного (изопикнического) центрифугирования требуется создание относительно высокой плотности раствора при одновременном сохранении вязкости среды. Хлорид цезия отвечает предъявляемым требованиям для высокоскоростного фракционирования ДНК, РНК, некоторых белков и нуклеотидов[К 7][34].
Прочие направления использования хлорида цезия включают:
- активация электродов при сварке молибдена[35];
- производство электропроводящего стекла[36];
- производство диоксида титана[37];
- производство буровых растворов[38];
- пивоварение и производство минеральной воды[39];
- реагент при определении жесткости воды методом измерения концентраций ионов кальция и магния пламенной атомно-абсорбционной спектрометрией[40];
- эффективный нетоксичный галогеноноситель для электроразрядных эксиплексных источников УФ-излучения[41];
- экспериментальный компонент флюсов для высокотемпературной пайки[42];
- экспериментальное средство для борьбы с насекомыми-вредителями некоторых сельскохозяйственных культур[43].
Применение в органической химии
Хлорид цезия относительно редко используется в органическом синтезе, однако описан ряд химических реакций, в которых применяется это соединение в качестве межфазного катализатора или нуклеофильного реагента:
- синтез производных глутаминовой кислоты[К 8][44]:
- реакция замещения в тетранитрометане[К 9][45]:
Применение в аналитической химии
Хлорид цезия находит широкое применение как аналитический реагент для проведения качественных реакций микрохимического обнаружения неорганических веществ по образованию характерных кристаллических осадков (микрокристаллоскопия). Примеры частных микрокристаллоскопических реакций с использованием CsCl приведены в таблице[46]:
Обнаруживаемый ион Сопутствующие реагенты Состав осадка Характеристика осадка Предел обнаружения, мкг AsO33− KI Cs2[AsI5] или Cs3[AsI6] красные шестиугольники 0,01 Au3+ AgCl, HCl Cs2Ag[AuCl6] почти черные крестики, четырех- и шестилучевые звезды 0,01 Au3+ KI, HCl Cs2[BiI5] • 2,5H2O красные шестиугольники 0,13 Cu2+ (CH3COO)2Pb, CH3COOH, KNO2 Cs2Pb[Cu(NO2)6] черные мелкие кубы 0,01 In3+ — Cs3[InCl6] мелкие октаэдры 0,02 [IrCl6]3− — Cs2[IrCl6] тёмно-красные мелкие октаэдры н/д Mg2+ Na2HPO4 CsMgPO4 • 6H2O мелкие тетраэдры н/д Pb2+ KI Cs[PbI3] жёлто-зеленые иглы, розетки 0,01 Pd2+ NaBr Cs2[PdBr4] буро-красные иглы и призмы н/д [ReCl4]− — Cs[ReCl4] тёмно-красные ромбы, бипирамиды 0,2 [ReCl6]2− — Cs2[ReCl6] зелено-жёлтые мелкие октаэдры 0,5 ReO4− — CsReO4 тетрагональные бипирамиды 0,13 Rh3+ KNO2 Cs3[Rh(NO2)6] жёлтые кубы 0,1 Ru3+ — Cs3[RuCl6] розово-красные иглы, палочки н/д [RuCl6]2− — Cs2[RuCl6] красно-бурые мелкие кристаллы 0,8 Sb3+ — Cs2[SbCl5] • nH2O шестиугольники 0,16 Sb3+ NaI Cs[SbI4] или Cs2[SbI5] красные шестиугольники 0,1 Sn4+ — Cs2[SnCl6] очень мелкие октаэдры 0,2 TeO33− HCl Cs2[TeCl6] светло-жёлтые октаэдры 0,3 Tl3+ NaI Cs[TlI4] оранжево-красные шестиугольники, прямоугольники, кубы 0,06 Используется хлорид цезия для следующих качественных аналитических реакций[К 10][47]:
Обнаруживаемый ион Сопутствующие реагенты Аналитическое определение Предел обнаружения, мг/мл Al3+ K2SO4 в нейтральной среде после высушивания без нагревания — бесцветные кристаллы 0,01 Ga3+ KHSO4 при небольшом нагревании выпадают бесцветные кристаллы 0,5 Cr3+ KHSO4 в слабокислой среде при упаривании выпадают бледно-фиолетовые кристаллы 0,06 Применение в медицине
Терапевтические свойства хлорида цезия были обнаружены ещё в 1888 году в лаборатории И.П.Павлова С.С. Боткиным. Соединение обладало выраженным гипертензивным и сосудосуживающим действием и было использовано для лечения нарушений сердечно-сосудистой системы[48].
Многочисленные клинические испытания показали, что хлорид цезия может быть эффективным противоопухолевым средством при комплексной терапии некоторых форм рака[49][50], однако использование этого препарата в настоящее время является экспериментальным (альтернативным) и, по мнению American Cancer Society (англ.)русск., требует дальнейшего изучения для оценки возможных рисков и последствий лечения[51].
Также в США был выдан патент на использование соединения в качестве стимулятора нервной системы. Отмечается, что CsCl очень эффективен для регулирования сердечной аритмии. В районах мира с повышенным содержанием солей цезия в рационе питания было отмечено увеличение продолжительности жизни. По предварительным экспериментальным данным хлорид цезия и другие его соли могут быть полезны для лечении маниакально-депрессивных расстройств[49]. Терапевтическое действие соединения при лечении нейродегенеративных заболеваний связана с тем, что CsCl защищает нейроны от апоптоза и активации каспазы-3, вызываемых низким содержанием ионов калия[52].
Помимо обычного хлорида цезия, отдельное применение в лучевой диагностике и радиотерапии находит 137CsCl — хлорид металла, в котором используется радиоактивный изотоп цезия 137Cs[53]. Другой радиоизотоп цезия 131Cs в виде хлорида также применяется как лечебно-диагностическое средство в брахитерапии[36] и, в частности, прямой диагностики инфаркта миокарда[54][55].
По состоянию на 30 июня 2012 года хлорид цезия не входит в Перечень лекарственных средств, зарегистрированных, внесенных в государственный реестр лекарственных средств и разрешенных к медицинскому применению в Российской Федерации[56].
Физиологическое действие и токсичность
Хлорид цезия является низко токсичным соединением, имеющим низкую степень опасности для человека[57]. Показатели токсичности:
- Крысы, внутрибрюшинно: ЛД50 1500 мг/кг;
- Крысы, перорально: ЛД50 2600 мг/кг;
- Мыши, перорально: ЛД50 2306 мг/кг;
- Мыши, внутривенно: ЛД50 910 мг/кг[4].
Токсические свойства хлорида цезия в больших концентрациях связаны со способностью этого соединения снижать содержание калия в организме и частично замещать его в биохимических процессах[58]. Пыль соединения может вызвать раздражение верхних дыхательных путей, респираторные расстройства, астму[38].
Комментарии
- ↑ 1 2 Расхождение данных значений со значениями, приведёнными ранее, объясняется разными источниками.
- ↑ Измерен относительно воздуха при длине волны 589 нм.
- ↑ Относительно чистой воды.
- ↑ Измерена при −51 °С и частоте электромагнитного поля 9,7•105 Гц.
- ↑ Приведена упрощённая схема реакции.
- ↑ Без учёта полуфабриката хлорида цезия, используемого для дальнейшего получения металлического цезия или иных соединений.
- ↑ Выбор хлорида цезия в качестве распространённой соли для равновесного ультрацентрифугирования обусловлен следующими причинами:
- хорошая растворимость соли в воде;
- высокая плотность концентрированных водных растворов (Cs очень тяжёлый элемент) при несущественном изменении вязкости среды;
- высокая крутизна профиля равновесного градиента для раствора от мениска до дна пробирки;
- химическая стабильность водных растворов CsCl.
- ↑ Обозначения в уравнении реакции:
- TBAB — бромид тетра-N-бутиламмония (межфазный катализатор);
- CPME — циклопентилметиловый эфир (растворитель).
- ↑ Обозначения в уравнении реакции:
- DMF — N,N-диметилформамид (растворитель).
- ↑ В дополнение к перечисленным выше качественным микрокристаллическим реакциям.
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под редакцией проф. Р.А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — 685 с. — ISBN 5-7107-8085-5
- ↑ 1 2 3 4 5 Краткий справочник физико-химических величин / Под редакцией проф. А. А. Равделя и А. М. Пономарёвой. — Издание девятое. — СПб.: «Специальная литература», 1998. — 232 с. — ISBN 5-86457-116-4
- ↑ 1 2 Таблица неорганических и координационных соединений. Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 23 февраля 2011.
- ↑ 1 2 Safety data for caesium chloride (англ.). Chemical and Other Safety Information. The Physical and Theoretical Chemistry Laboratory Oxford University. Архивировано из первоисточника 18 августа 2011. Проверено 8 апреля 2011.
- ↑ 1 2 Цезий // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1998. — Т. 5. — С. 654—656. — ISBN 5-85270-310-9
- ↑ 1 2 3 4 5 6 7 Плющев В. Е., Стёпин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.: «Химия», 1970. — 406 с.
- ↑ Hackspill M. L. Sur une nouvelle prepapratíon du rubidium et du cæsium (фр.) // Comptes rendus hebdomadaires des séances de l'Académie des sciences. — 1905. — Т. 141. — С. 106.
- ↑ Савинкина Е. Цезий, страница 2. Онлайн Энциклопедия «Кругосвет». Архивировано из первоисточника 18 августа 2011. Проверено 26 февраля 2011.
- ↑ Ионная связь // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1990. — Т. 2. — С. 506. — ISBN 5-85270-035-5
- ↑ 1 2 3 4 5 6 7 8 9 10 CRC Handbook of Chemistry and Physics / Editor-in-Chief David R. Lide. — 85-th edition. — CRC Press, 2005. — 2656 p. — ISBN 978-0849304859
- ↑ 1 2 Турова Н. Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 85.
- ↑ Refractive index and related constants - CsCl (Cesium chloride). Refractive index database RefractiveIndex.INFO. Архивировано из первоисточника 18 августа 2011. Проверено 11 мая 2011.
- ↑ Ионные кристаллы // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1990. — Т. 2. — С. 510. — ISBN 5-85270-035-5
- ↑ ЭСБЕ/Цезий. Энциклопедический словарь Брокгауза и Ефрона. Санкт-Петербург, 1890—1907. Викитека. Архивировано из первоисточника 18 августа 2011. Проверено 15 апреля 2011.
- ↑ 1 2 Цезия галогениды // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1998. — Т. 5. — С. 657. — ISBN 5-85270-310-9
- ↑ 1 2 Растворимость неорганических соединений в смешанных и неводных растворителях. Новый справочник химика и технолога. Химическое равновесие. Свойства растворов. ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 24 февраля 2011.
- ↑ 1 2 3 Плющев В. Е., Стёпин Б. Д. Аналитическая химия рубидия и цезия. — М.: «Наука», 1975. — С. 22—26. — (Аналитическая химия элементов).
- ↑ Плющев В. Е., Стёпина С. Б., Фёдоров П. И. Химия и технология редких и рассеянных элементов / Под редакцией К. А. Большакова. — Изд. 2-е, перераб. и доп. — М.: «Высшая школа», 1976. — Т. 1. — С. 101—103.
- ↑ Matsuoa H., Kogab Y., Sawamura S. Solubility of cesium chloride in water under high pressures (англ.) // Fluid Phase Equilibria. — 2001. — Т. 189. — № 1—2. — С. 1—11.
- ↑ Давление пара в зависимости от температуры. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 23 февраля 2011.
- ↑ Растворимость неорганических соединений в смешанных и неводных растворителях. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 24 февраля 2011.
- ↑ Удельная электрическая проводимость твердых и расплавленных солей. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 24 февраля 2011.
- ↑ 1 2 3 4 Диффузия в твёрдой фазе. Новый справочник химика и технолога. Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия. ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 24 февраля 2011.
- ↑ 1 2 3 Cesium and Cesium Compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4-th edition. — New York: John Wiley & Sons, 1994. — Т. 5. — P. 375—376.
- ↑ Соединения цезия. ЗАО «Завод редких металлов». Архивировано из первоисточника 18 августа 2011. Проверено 4 марта 2011.
- ↑ Halka M., Nordstrom B. Alkali and Alkaline Earth Metals. — New York: Facts On File, 2010. — P. 52. — ISBN 978-0-8160-7369-6
- ↑ 1 2 3 Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под редакцией проф. Р.А.Лидина. — 3-е изд.. — М.: «Химия», 2000. — С. 49. — ISBN 5-7245-1163-0
- ↑ Бария хлорид // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 463.
- ↑ Consolidated Index of Selected Property Values: Physical Chemistry and Thermodynamics / National Research Council (U.S.). Office of Critical Tables. — Publication 976. — Washington, D.C.: National Academy of Science, 1962. — P. 271.
- ↑ Полигалогениды // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1992. — Т. 3. — С. 1237—1238. — ISBN 5-85270-039-8
- ↑ Цезий. Большая советская энциклопедия. Яндекс.Словари. Архивировано из первоисточника 18 августа 2011. Проверено 26 февраля 2011.
- ↑ Менделевий // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1992. — Т. 3. — С. 57. — ISBN 5-85270-039-8
- ↑ Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 207. — ISBN 0-07-049439-8
- ↑ Остерман Л. А. Методы исследования белков и нуклеиновых кислот: Электрофорез и ультрацентрифугирование (практическое пособие). — М.: «Наука», 1981. — С. 240—263. — 288 с.
- ↑ Тугоплавкие и химически активные металлы. Migatronic. Архивировано из первоисточника 18 августа 2011. Проверено 24 февраля 2011.
- ↑ 1 2 Cesium (англ.) (pdf). Mineral Commodity Summaries. U.S. Geological Survey (January 2010). Архивировано из первоисточника 18 августа 2011. Проверено 14 апреля 2011.
- ↑ Cesium Chloride 99.99 (англ.) (pdf). Chemetall GmbH, Special Metals Division (2008). Архивировано из первоисточника 18 августа 2011. Проверено 10 апреля 2011.
- ↑ 1 2 Cesium Chloride MSDS (англ.) (pdf). Cesium Fine Chemicals. Cabot Corporation. Архивировано из первоисточника 18 августа 2011. Проверено 11 апреля 2011.
- ↑ Cesium chloride // Academic Press Dictionary of Science and Technology / Edited by Morris Ch. G.. — San Diego: Academic Press, 1992. — P. 395. — 2432 p. — ISBN 0-12-200400-0
- ↑ ГОСТ 52407-2005. Вода питьевая. Методы определения жесткости. — Издание официальное. — М.: Стандартинформ, 2006. — 16 с.
- ↑ Кленовский М. С., Кельман В. А., Жменяк Ю. В., Шпеник Ю. О. Электроразрядный источник УФ-излучения на основе парогазовой смеси Xe—CsCl // Журнал технической физики. — 2010. — Т. 80. — № 5. — С. 117—122.
- ↑ Industrial Minerals & Rocks: Commodities, Markets, and Uses / Edited by Kogel J. E., Trivedi N. C., Barker J. M. — Seven edition. — Littleton: Society for Mining, Metallurgy, and Exploration, 2006. — P. 1430. — 1548 p. — ISBN 978-0-87335-233-8
- ↑ Qureshi J. A., Buschman L. L., Throne J. E., Whaley P. M., Ramaswamy S. B. Rubidium Chloride and Cesium Chloride Sprayed on Maize Plants and Evaluated for Marking Diatraea grandiosella (Lepidoptera: Crambidae) in Mark–Recapture Dispersal Studies (англ.) // Environmental Entomology. — 2004. — Т. 33. — № 4. — С. 930—940. — DOI:10.1603/0046-225X-33.4.930
- ↑ Kano T., Kumano T., Maruoka K. Rate Enhancement of Phase Transfer Catalyzed Conjugate Additions by CsCl (англ.) // Organic Letters. — 2009. — Т. 11. — № 9. — С. 2023—2025.
- ↑ Katritzky A. R., Meth-Cohn O., Rees Ch. W. Comprehensive Organic Functional Group Transformations / Volume editor: Gilchrist T. L.. — First edition. — New York: Elsevier, 1995. — Vol. 6: Synthesis: Carbon with Three or Four Attached Heteroatoms. — P. 283. — 933 p. — ISBN 978-0-080406046
- ↑ Микрокристаллоскопия. Новый справочник химика и технолога. Аналитическая химия (часть II). ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 24 февраля 2011.
- ↑ Химические методы обнаружения ионов.(Качественный химический метод анализа). Новый справочник химика и технолога. Аналитическая химия (часть II). ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 24 февраля 2011.
- ↑ Цезий. Медицинские справочники. Столица-Медикл. Архивировано из первоисточника 18 августа 2011. Проверено 10 мая 2011.
- ↑ 1 2 Brewer A. K. The High pH Therapy for Cancer Tests on Mice and Humans (англ.) // Pharmacology Biochemistry & Behavior. — 1984. — Т. 21. — № 1. — С. 1—5.
- ↑ Low J. C., Wasan K. M., Fazli L., Eberding A., Adomat H., Guns E. S. Assessing the therapeutic and toxicological effects of cesium chloride following administration to nude mice bearing PC-3 or LNCaP prostate cancer xenografts (англ.) // Cancer Chemother Pharmacology. — 2007. — Т. 60. — № 6. — С. 821—829.
- ↑ Cesium Chloride. Complementary and Alternative Medicine: Herbs, Vitamins, and Minerals. American Cancer Society. Архивировано из первоисточника 18 августа 2011. Проверено 13 мая 2011.
- ↑ Zhong J., Yaoa W., Lee W. Cesium chloride protects cerebellar granule neurons from apoptosis induced by low potassium (англ.) // International Journal of Developmental Neuroscience. — 2007. — Т. 25. — № 6. — С. 359—365.
- ↑ Источники радиоактивных загрязнений. Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы. ChemAnalytica.com. Архивировано из первоисточника 18 августа 2011. Проверено 23 февраля 2011.
- ↑ Carr E. A., Gleason G. B., Shaw J., Krontz B., Arbor A. The direct diagnosis of myocardial infarction by photoscanning after administration of cesium-131 (англ.) // American Heart Journal. — 1964. — Т. 68. — № 5. — С. 627—636.
- ↑ McGeehan J. T., Rodríguez-Antúnez A., Lewis R. C. Cesium 131 Photoscan: Aid in the Diagnosis of Myocardial Infarction (англ.) // The Journal of the American Medical Association. — 1968. — Т. 204. — № 7. — С. 585—589.
- ↑ Государственный реестр лекарственных средств. Министерство здравоохранения и социального развития РФ. Архивировано из первоисточника 18 августа 2011. Проверено 30 июня 2012.
- ↑ Chemical Safety Data: Caesium chloride (англ.). Hands-on Science (H-Sci) Project: Chemical Safety Database. Physical and Theoretical Chemistry Laboratory, Oxford University. Архивировано из первоисточника 18 августа 2011. Проверено 8 апреля 2011.
- ↑ Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под ред. проф. Н. В. Лазарева и проф. И. Д. Гадаскиной. — Издание 7-е, пер. и доп. — Л.: Химия, 1977. — Т. 3. — С. 328—329.
Литература
- Плющев В. Е., Стёпин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.: «Химия», 1970. — С. 96—100. — 406 с.
- Cassileth B. R., Yeung K. S., Gubili J. Cesium Chloride // Herb-Drug Interactions in Oncology. — Second edition. — PMPH-USA, 2010. — P. 158—160. — 769 p. — ISBN 978-1-60795-041-7
- Eldridge J. E. Cesium Chloride (CsCl) // Handbook of Optical Constants of Solids / Edited by Edward D. Palik. — London: Academic Press, 1998. — Vol. 3. — P. 731—741. — ISBN 0-12-544423-0
- Toxicological Profile for Cesium. — Atlanta: Agency for Toxic Substances and Disease Registry, 2004. — 306 p.
Ссылки
- Кристаллическая структура хлорида цезия (англ.). Архивировано из первоисточника 18 августа 2011. Проверено 3 марта 2011.
- Java 3D-модель кристаллической решётки хлорида цезия (англ.). Архивировано из первоисточника 18 августа 2011. Проверено 8 апреля 2011.
- Оптические характеристики кристалла хлорида цезия (англ.). Архивировано из первоисточника 18 августа 2011. Проверено 13 мая 2011.
Соединения цезияАзид цезия (CsN3) • Алюминий-цезий сульфат (CsAl(SO4)2) • Амид цезия (CsNH2) • Ацетат цезия (CsCH3COO) • Аурид цезия (CsAu) • Бензоат цезия (CsC6H5COO) • Борогидрид цезия (CsBH4) • Бромат цезия (CsBrO4) • Бромид цезия (CsBr) • Бромид-дииодид цезия (CsBrI2) • Бромид-дихлорид цезия (CsBrCl2) • Бромид-иодид-хлорид цезия (CsBrClI) • Гексафторогерманат цезия (Cs2[GeF6]) • Гексафторокупрат(IV) цезия (Cs2CuF6) • Гексафторсиликат цезия (Cs2SiF6) • Гексафторхромат(V) цезия (CsCrF6) • Гептафторксенат цезия (CsXeF7) • Гидрид цезия (CsH) • Гидроксид цезия (CsOH) • Гидросульфат цезия (CsHSO4) • Гипофосфит цезия (CsPO2) • Дибромид-иодид цезия (CsBr2I) • Дибромидхлорид цезия (CsBr2Cl) • Дигидроортофосфат цезия (CsH2PO4) • Дихромат цезия (Cs2Cr2O7) • Иодат цезия (CsIO3) • Иодид-дихлорид цезия (CsICl2) • Иодид цезия (CsI) • Карбонат цезия (Cs2CO3) • Лактат цезия (CsCH3CHOHCOO) • Метаборат цезия (CsBO2) • Молибдат цезия (CsMoO4) • Надпероксид цезия (CsO2) • Нитрат цезия (CsNO3) • Нитрид цезия (Cs3N) • Нитрит цезия (CsNO2) • Озонид цезия (CsO3) • Оксид цезия (Cs2O) • Октафторксенат(VI) цезия (Cs2XeF8) • Пентаиодид цезия (CsI5) • Перманганат цезия (CsMnO4) • Пероксид цезия (Cs2O2) • Перхлорат цезия (CsClO3) • Полисульфиды цезия (Cs2Sn) • Сульфат цезия (Cs2SO4) • Сульфид цезия (Cs2S) • Тетраборат цезия (Cs2B4O7) • Тетрагидридоборат(III) цезия (Cs[BH4]) • Тетрагидроалюминат цезия (CsAlH4) • Тиоцианат цезия (CsSCN) • Трибромид цезия (CsBr3) • Трииодид цезия (CsI3) • Формиат цезия (CsCOOH) • Фосфид цезия (Cs2P5) • Фторид цезия (CsF) • Хлорат цезия (CsClO4) • Хлорид цезия (CsCl) • Хромат цезия (Cs2CrO4)
Эта статья входит в число хороших статей русскоязычного раздела Википедии. Категории:- Соединения цезия
- Хлориды
- Галогениды металлов
- Противоопухолевые средства
Wikimedia Foundation. 2010.

![\mathsf{2CsCl+Ca\ \xrightarrow[P]{700-800\ ^oC}\ CaCl_2+2Cs}](302e6a6a27d58890d57a2562f6f925f2.png)




![\mathsf{CsCl+ICl=Cs[I(Cl)_2]\downarrow}](4ebf81be2aa9c0685e6653893f01d0c3.png)
![\mathsf{2CsCl+CeCl_4=Cs_2[CeCl_6]\downarrow}](51064ba62e401df75295abd39df4fbed.png)

![\mathsf{Cs[I(Cl)_2] \rightarrow CsCl+ICl\uparrow}](06b0c366cef7a7c4bace3282db623eae.png)
![\mathsf{CsCl+6H_2O=[Cs(H_2O)_6]^++Cl^-}](5878b1a9db198e269e31acb81e641609.png)


![\mathsf{2CsCl+H_2[PtCl_6]=2HCl+Cs_2[PtCl_6]\downarrow}](2d41683475ae0c8ea5680fd40cb14641.png)
![\mathsf{2CsCl+H_2[CeCl_6]=2HCl+Cs_2[CeCl_6]\downarrow}](f2eb110537b6803b5daca9b71e919901.png)



![\mathsf{CsCl+ICl_3=Cs[ICl_4]}](802619fa55d019cc417efd47d912a846.png)
![\mathsf{2CsCl+Mg\ \xrightarrow[P]{700-800\ ^oC}\ MgCl_2+2Cs}](43e4ddb9c16666be4643a32155a85171.png)

![\mathsf{CH_2\!\!=\!\!CHCOOCH_3+ArCH\!\!=\!\!N\!\!-\!\!CH(CH_3)\!\!-\!\!COOC(CH_3)_3\ \xrightarrow[CPME,\ 0^oC]{TBAB,\ CsCl,\ K_2CO_3}\ ArCH\!\!=\!\!N\!\!-\!\!C(C_2H_4COOCH_3)(CH_3)\!\!-\!\!COOC(CH_3)_3}](3054029d49dd40cbd757180bf0930f4a.png)
![\mathsf{C(NO_2)_4+CsCl\ \xrightarrow[]{DMF}\ C(NO_2)_3Cl+CsNO_2}](b1bf2e60fa9979432bbebfdd1097becd.png)