- Бромид цезия
-
Бромид цезия 
Общие Систематическое наименование Бромид цезия Традиционные названия Бромид цезия Химическая формула CsBr Эмпирическая формула CsBr Физические свойства Состояние (ст. усл.) твёрдое Примеси Rb, Ca, Na Молярная масса 212,81 г/моль Плотность 4,43[1] г/см³ Термические свойства Температура плавления 637[1] °C Температура кипения 1297[1] °C Оптические свойства Показатель преломления 1,6984[2] Классификация Рег. номер CAS 7787-69-1 Рег. номер EINECS 232-130-0 SMILES [Cs+].[Br-] RTECS FK9275000 Безопасность ЛД50 1400[3] мг/кг Броми́д це́зия (цезий бромистый) — CsBr, неорганическое бинарное соединение цезия и брома, цезиевая соль бромоводородной кислоты. Бесцветное (в кристаллическом виде) вещество с ионной структурой; нелетучее, термически устойчивое, хорошо растворимое в воде. Кристаллическая решётка CsBr — кубическая объемноцентрированная типа CsCl.
Содержание
Молекулярная и кристаллическая структура
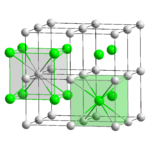
Бромид цезия — соединение с ярко выраженной ионной структурой (ионный кристалл), где каждый ион цезия Cs+ окружен восемью ионами брома Br−. Энергия ионизации, I = 7,78 эВ[1]:[стр. 373]. Энергия атомизации (Eсв) равна 395 кДж/моль[1]:[стр. 380]. Бромид цезия в газообразном состоянии содержит молекулы димера Cs2Br2 плоской ромбической формы[4].
Кристаллическая решётка соединения кубическая, примитивная (α-CsBr), пространственная группа P m3m, a = 0,429 нм, Z = 1.
При нагревании α-CsBr переходит в гранецентрированную модификацию β-CsBr (тип NaCl)[5]:[стр. 91]. Пространственная группа F m3m, a = 0,723 нм, Z = 4. Энергия кристаллической решётки U = 625,9 кДж/моль[5]:[стр. 101]. Длина связи Cs—Br в газообразном состоянии составляет 307 пм[4], в жидком — 355 пм, твёрдом — 362 пм[6]. При температуре жидкого гелия в кристаллах бромида цезия происходит скольжение дислокации, приводящее к аномальной пластичности и тягучести соединения[7].
Элементный состав соединения: Cs 62,45 %, Br 37,55 %.
Физические свойства
Бромид цезия в нормальных условиях представляет собой бесцветное (в крупно-кристаллическом виде) или белое (в виде порошка) соединение хорошо растворимое в воде (123,3 грамм CsBr в 100 г H2O при 50 °С, 214 г при 80 °С)[1]:[стр. 620]. Теплота растворения в воде при комнатной температуре составляет −25,96 кДж/моль[8]. Не образует кристаллогидратов[9]. Из водных растворов кристаллизуется в виде безводных кубов или ромбических додекаэдров[5]:[стр. 100].
Плотность водного раствора CsBr при 20 °C[1]:[стр. 645]:
1 % 2 % 4 % 6 % 8 % 10 % 12 % 14 % Плотность, г/л 1006,1 1014,1 1030,5 1047,3 1064,7 1082,7 1101,2 1120,3 16 % 18 % 20 % 22 % 24 % 30 % 35 % 40 % 1140,1 1160,5 1181,7 1203,6 1226,3 1299,7 1367,6 1442,8 Соединение растворимо в метаноле, этаноле; хорошо растворимо в муравьиной кислоте и гидразине; плохо растворимо в ацетоне, пиридине, эфире, ацетонитриле, нитробензоле[9].
Хорошо растворим в бромоводородной кислоте. Зависимость максимальной концентрации CsBr (по массе) в водном растворе HBr различной концентрации при 25 °C[9]:
Концентрация HBr, % 5 % 10 % 15% 20 % 25 % Концентрация CsBr, % 49,0 40,6 33,3 27,9 23,4 Основные термодинамические характеристики[1]:[стр. 462, 532]:
в газообразном состоянии:
- стандартная энтальпия образования, ΔHo298 = −208 кДж/моль;
- стандартная энтропия образования, So298 = 267 Дж/(моль·K);
- стандартная энергия Гиббса образования, ΔGo298 = −240 кДж/моль.
в кристаллическом состоянии:
- стандартная энтальпия образования, ΔHo298 = −392 кДж/моль;
- стандартная энтропия образования, So298 = 117 Дж/(моль·K);
- стандартная энергия Гиббса образования, ΔGo298 = −379 кДж/моль.
Получение
В лабораторных условиях бромид цезия может быть получен взаимодействием гидроксида, карбоната, гидрокарбоната или сульфида цезия с бромистоводородной кислотой:
Возможный альтернативный вариант — обменная реакция карбоната цезия с бромидом кальция или бария:
Химические свойства
Бромид цезия — термически довольно устойчивое соединение. В отсутствие воды в газообразном состоянии при температуре 2100—2400 K степень диссоциации молекул CsBr не превышает 0,025[10].
Концентрированный водный раствор бромида цезия реагирует с жидким бромом с образованием дибромобромата(I) цезия[11]:
Действием увлажнённого хлора на тонкоизмельченный бромид цезия можно получить дихлоробромат(I) цезия[12]:
Применение
- Входит в состав люминофоров для люминесцентных экранов, используемых в радиографии[13];
- Источник щелочного металла (основа специальных таблеток) для термоионных детекторов, используемых в селективной газовой хроматографии;
Применение в оптике
Комментарии
Примечания
- ↑ 1 2 3 4 5 6 7 8 Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под редакцией проф. Р.А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — 685 с. — ISBN 5-7107-8085-5
- ↑ Таблица неорганических и координационных соединений. Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalytica.com. Архивировано из первоисточника 28 июля 2012. Проверено 15 апреля 2011.
- ↑ Safety data for caesium bromide (англ.). Chemical and Other Safety Information. The Physical and Theoretical Chemistry Laboratory Oxford University. Архивировано из первоисточника 28 июля 2012. Проверено 15 апреля 2011.
- ↑ 1 2 Турова Н. Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 85.
- ↑ 1 2 3 Плющев В. Е., Стёпин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.: «Химия», 1970. — 406 с.
- ↑ Danek V. Physico-Chemical Analysis of Molten Electrolytes. — First edition. — Elsevier, 2006. — P. 11. — 449 p. — ISBN 0-444-52116-X
- ↑ Koizumi H., Suzuki T. Dislocation Motion in Alkali-Halides with CsCl Structure // Dislocations in Solids / Edited by Suzuki H., Ninomiya T., Sumino K., Takeuchi Sh.. — University of Tokio Press: Yamada Science Foundation, 1985. — P. 479. — 672 p. — (Yamada Conference IX). — ISBN 4-13-068113-3
- ↑ Mullin J. W. Crystallization. — Fourth edition. — Oxford: Butterworth-Heinemann, 2001. — P. 521. — 594 p. — ISBN 0-7506-4833-3
- ↑ 1 2 3 Цезия галогениды // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1998. — Т. 5. — С. 657. — ISBN 5-85270-310-9
- ↑ Шумилов А. А. Термодинамические расчёты фазового состава летучих продуктов деления в топливной полости, МЭЗ и ВЦС // Материалы 13-ой Международной телекоммуникационной конференции молодых ученых и студентов «Молодежь и наука». Секция 1.12: Физика, химия и компьютерная разработка материалов. — 2009.
- ↑ Степин Б. Д., Плющев В. Е., Факеев А. А. Анионгалогенааты щелочных металлов и аммония // Успехи химии. — 1965. — Т. 34. — № 11. — С. 1890.
- ↑ Цезий - фотографии (рус.). Химия и Химики № 3 2012. Журнал Химия и Химики. Архивировано из первоисточника 10 августа 2012. Проверено 29 июля 2012.
- ↑ Vandenbroucke D. A. N., Leblans P. J. R. CR Mammography: Image Quality Measurement and Model Calculation for Needle vs. Powder Imaging Plate (англ.) // Digital Mammography: Lecture Notes in Computer Science. — 2010. — Т. 6136. — С. 219—226. — DOI:10.1007/978-3-642-13666-5_30
Литература
Ссылки
Категории:- Соединения цезия
- Бромиды
- Галогениды металлов
Wikimedia Foundation. 2010.




![\mathsf{CsBr+Br_2=Cs[Br(Br)_2]}](6627ad61885889a90c587d2519150e7b.png)
![\mathsf{CsBr+Cl_2=Cs[Br(Cl)_2]}](98fb5eee69630923776433529d81a6d5.png)