- Хлорциан
-
Хлорциан 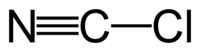
Общие Сокращения CK Химическая формула ClCN Физические свойства Состояние (ст. усл.) бесцветный газ Молярная масса 61,46 г/моль Плотность при -30 °C - 1.550 г/см³ Термические свойства Температура плавления -6,9 °C Температура кипения 12,6 °C Энтальпия образования (ст. усл.) 134.2 кДж/моль Классификация Рег. номер CAS 506-77-4 SMILES C(#N)Cl Хлорциан — хлорангидрид циановой кислоты ClCN, бесцветный газ (при нормальных условиях) с резким запахом, высокотоксичен. Хлорциан — легко сжижающийся газ (давление паров при 20 С = 1002 мм.рт.ст) с температурой кипения −6.9 °C, в твердой фазе образует кристаллы ромбической сингонии.
Содержание
Реакционная способность
Хлорциан является типичным псевдогалогеном и обладает высокой реакционной способностью по отношению к нуклеофилам, для него типичны как реакции замещения хлора, так и присоединения к тройной связи. Так, он взаимодействует с щелочами с образованием цианатов щелочных металлов:
- ClCN + 2 NaOH
 NaOCN + NaCl + H2O
NaOCN + NaCl + H2O
Хлорциан медленно гидролизуется водой в нейтральных и кислых растворах с образованием изоциановой кислоты, которая, в свою очередь, гидролизуется с образованием до аммиака и диоксида углерода:
- ClCN + H2O
 HNCO + HCl
HNCO + HCl - HNCO + H2O
 NH3 + CO2
NH3 + CO2
C аммиаком хлорциан образует цианамид:
- ClCN + NH3
 H2N-CN + HCl
H2N-CN + HCl
Реакции с азотными и кислородными нуклеофилами, начинаясь с замещения хлора, могут сопровождаться последующим присоединением к тройной углерод-азотной связи: так, первичные и вторичные амины образуют с хлорцианом сначала N-замещенные цианамиды, а затем — гуанидины:
- ClCN + R2NH
 R2N-CN + HCl
R2N-CN + HCl - R2N-CN + R2N-CN
 (R2N)2C=NH
(R2N)2C=NH
В отличие от аминов, при взаимодействие хлорциана со спиртами продукты замещения алкоксилом хлора — эфиры циановой кислоты — не образуются, реакция ведет к образованию нестойких имидоэфиров угольной кислоты:
- ClCN + 2 ROH
 (RO)2C=NH + HCl
(RO)2C=NH + HCl
Хлорциан реагирует и с углеродными нуклеофилами, при этом идут реакции замещения хлора. Так, хлорциан при взаимодействии с реактивами Гриньяра образует нитрилы:
- RMgCl + ClCN
 RCN + MgCl2
RCN + MgCl2
Ароматические углеводороды цианируются хлорцианом в условиях реакции Фриделя-Крафтса[1]:
- ArH + ClCN
 Ar-CN + HCl, в частности, бензол в этих условиях образует бензонитрил, однако эта реакция имеет ограниченное синтетическое применение.
Ar-CN + HCl, в частности, бензол в этих условиях образует бензонитрил, однако эта реакция имеет ограниченное синтетическое применение.
Токсичность
По действию хлорциан аналогичен синильной кислоте, поскольку при гидролизе в организме образует цианид-ионы, но в отличие от неё оказывает и раздражающее действие, обусловленное воздействием хлорциана на нуклеофильные функциональные группы рецепторов слизистых оболочек. Смертельная концентрация хлорциана в воздухе: ЛКτ50 = 11 мг·мин/л.
Хлорциан не обладает кумулятивными свойствами, его воздействие проявляется немедленно. При концентрации 0,002 мг/л начинает ощущаться раздражающее действие, а при 0,06 мг/л развивается обильное слезотечение и спазм век. Концентрация 0,4 мг/л может вызвать смертельный исход (достаточно 10-минутного воздействия, при этом смерть наступает в течение 1-15 минут).
Применение
В химическом производстве
Хлорциан является исходным веществом в синтезе цианурхлорида (2,4,6-трихлор-1,3,5-триазина), применяющегося в синтезе гербицидов триазинового ряда и триазиновых активных красителей, синтез проводится каталитической тримеризацией хлорциана:
- 3CICN
 C3N3CI3
C3N3CI3
Как отравляющее веществo
Хлорциан также производился в качестве боевого отравляющего вещества общеядовитого действия, впервые был применен войсками Антанты в июле 1916 года в ходе Первой мировой войны.[2]
Хлорциан, обладающий схожим с синильной кислотой характером токсического действия и уровнем летальной дозы, очень плохо сорбируется угольной шихтой противогаза. При подходящих метеоусловиях можно создавать такие концентрации хлорциана, при которых наступает пробой противогаза, и живая сила противника будет поражена, даже если успеет воспользоваться стандартными средствами защиты от ОВ.[3]
Примечания
- ↑ Gore, P. H.; F. S. Kamounah, A. Y. Miri (1979). «Friedel-crafts cyanation of some reactive aromatic hydrocarbons». Tetrahedron 35 (24): 2927-2929. DOI:10.1016/S0040-4020(01)99510-9. ISSN 0040-4020. Проверено 2011-04-18.
- ↑ Chemical Weapons in World War I
- ↑ Химическое оружие на рубеже двух столетий
Литература
- В. Н. Александров, В. И. Емельянов Отравляющие вещества — Москва, Военное изд-во — 1990
Ссылки
Боевые отравляющие вещества Общеядовитого действия Циановодород (AC) · Хлорциан (CK) · Арсин (SA) · Фосфин (PH) · Угарный газ (CO) Удушающего действия Фосген (CG) · Дифосген (DP) · Хлор (CL) Кожно-нарывного действия Иприт (HD) · Люизит (L) · Метилдихлорарсин (MD) · Этилдихлорарсин (ED) · Фенилдихлорарсин (PD) · Сесквииприт (Q) · Азотистые иприты (HN1, HN2, HN3) · Кислородный иприт (T) Нервно-паралитического действия V-агенты VE · VP · VS · VR · VM · VX · Амитон (VG) · EA 3148 G-агенты Табун (GA) · Зарин (GB) · Зоман (GD) · Циклозарин (GF) · Этилзарин (GE) · GV Раздражающего действия
(ирританты)Слезоточивые вещества
(лакриматоры)Хлорацетофенон (CN) · Хлорпикрин (PS) · Акролеин (DG) · Камит (CA) · Мартонит (BA) · Метилизоцианат Чихательные вещества
(стерниты)Адамсит (DM) · Дифенилхлорарсин (DA) · Дифенилцианарсин (DC) Комплексные Дибензоксазепин (CR) · Хлорбензальмалондинитрил (CS) Психохимического действия
(инкапаситанты)Хинуклидил-3-бензилат (BZ) · Фенциклидин (SN) · ЛСД (K) · Апоморфин · EA 3167 Болевого действия (алгогены) 1-метокси-1,3,5-циклогептатриен (CH) Метаболические яды
(цитотоксиканты)1,2-дихлорэтан · Оксид этилена · Полихлордибензодиоксины (ПХДД) · Полихлордибензофураны (ПХДФ) Категории:- Химическое оружие
- Цианиды
- Хлориды
- ClCN + 2 NaOH
Wikimedia Foundation. 2010.
