- Хлорпикрин
-
Хлорпикрин 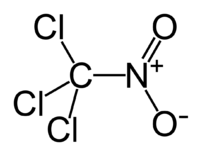
Общие Систематическое наименование Хлорпикрин, нитрохлороформ, трихлорнитрометан. Химическая формула CCl3NO2 Физические свойства Состояние (ст. усл.) жидкость Молярная масса 164.376 г/моль Плотность 1,6539 (20 °C) г/см³ Термические свойства Температура плавления -69 °C Температура кипения 112,3 °C Классификация SMILES C([N+](=O)[O-])(Cl)(Cl)Cl Хлорпикри́н (трихлорнитрометан) CCl3NO2 — жидкость с резким раздражающим запахом; технический продукт может иметь различные оттенки запаха в зависимости от чистоты и способа получения. Используется как компонент фумигантных смесей в сельском хозяйстве[1].
Содержание
Методы синтеза
Хлорпикрин впервые получил Стенхауз еще в 1848 году при взаимодействии 2,4,6-тринитрофенола (пикриновой кислоты) с хлорной известью. Позднее этот старинный процесс был использован в промышленных процессах, при помощи которых в первую мировую войну хлорпикрин получали для военных целей. Действие гипохлоритов кальция (т.е. дешёвой хлорной извести) приводит к расщеплению цикла 2,4,6- тринитрофенола и одновременно к хлорированию продуктов расщепления.
Вместо трудно растворимой пикриновой кислоты применяли легкорастворимый пикрат кальция, который получали смешением пикриновой кислоты с окисью кальция, и к смеси добавляли кашицу хлорной извести. Теплоты этой реакции достаточно для испарения образующегося хлорпикрина, пары которого затем конденсируют. Затем хлорпикрин легко перегоняется с водяным паром для очистки.
В реакции можно использовать не только хлорную известь, но другие гипохлориты - в том числе и образующиеся in situ при пропускании хлора в щелочной раствор пикриновой кислоты либо других нитрофенолов.
В настоящее время основным промышленным способом синтеза хлорпикрина является хлорирование нитрометана в щелочной среде:
- CH3NO2 + 3NaOCl
 Cl3CNO2 + 3NaOH
Cl3CNO2 + 3NaOH
Хлорпикрин может также быть синтезирован нитрованием хлороформа ацетилнитратом:
- CHCl3 + CH3COONO2
 Cl3CNO2 + CH3COOH
Cl3CNO2 + CH3COOH
Физико-химические свойства
Хлорпикрин-бесцветная, маслянистая, сильно преломляющая свет жидкость с резким специфическим запахом. На свету он становится зеленовато-желтоватым, что можно объяснить частичным его разложением с образованием хлора и окислов азота. Т. кип. 112—113 °C (760 мм рт. ст.) и 49 °C (40 мм рт. ст.), т. пл. — 62,2 (64) °С.
Зависимость давления пара, максимальной концентрации от давления.
Температура, °C Давление пара, мм рт. ст. Максимальная концентрация, мг/л 0 5,91 57 10 10,87 104 20 16,91 184 30 30,50 295 Широкий температурный интервал, в котором хлорпикрин существует в жидком состоянии, и его высокая летучесть даже при низких температурах позволяет применять его в любое время года. В зимние месяцы достигается концентрация, меньшая абсолютно токсичной, но достаточная для подавления противника.
Стойкость на местности, лишенной растительности, составляет при обычной температуре около 6 ч. В этот период выход на зараженную местность или ее преодоление без противогаза невозможны. Растворимость в воде при 25 °C, составляет 0,16 %. Хлорпикрин хорошо растворим в органических растворителях.
Из неорганических растворителей он хорошо растворяется в четыреххлористом кремнии и олове. Следует отметить, что хорошая смешиваемость с ОВ, например с ипритом, азотистым ипритом, дифосгеном, фосгеном, фосфорорганическими ОВ, делает хлорпикрин важным компонентом для тактических смесей, особенно в случае сравнительно низкоплавких ОВ, в результате чего становится возможным их применение в зимнее время.
Водой хлорпикрин не гидролизуется. Хлорпикрин легко дегазируется спиртовым раствором сульфида натрия, или растворами гидразина.
Хлорпикрин при высоком давлении и нагревании превращается в фосген.
Токсические свойства
Хлорпикрин раздражает кожу и слизистые оболочки. Он вызывает слезотечение, смыкание век, бронхит и отёк лёгких. Жидкий хлорпикрин вызывает тяжёлые поражения кожи.
У большинства людей концентрация 0,002 мг/л за 3-30 сек вызывает слезотечение и смыкание век, концентрация 0,05 мг/л — непереносима. Более высокие концентрации ведут к болям в области желудка, рвоте и потере сознания. Концентрация около 0,2 мг/л за несколько секунд или минут приводит к полной утрате боеспособности.
Поражение органов дыхания появляется при концентрации выше 0,1 мг/л. В качестве смертельной концентрации указывают 2 мг/л при экспозиции 10 мин. При такой концентрации смерть наступает в течение нескольких минут.
Хлорпикрин как боевое отравляющее вещество
Пары хлорпикрина обладают сильным слезоточивым, а в высоких концентрациях — удушающим и общеядовитым действием. В этой связи хлорпикрин ограниченно применялся в Первой мировой войне как боевое отравляющее вещество (впервые, по некоторым данным, русской армией в конце 1915 года), а также в качестве растворителя для боевого применения других БОВ (впервые - в середине 1916 года немецкой армией в смеси с дифосгеном).
Из-за невысокой для современных ОВ токсичности и сильного раздражающего действия хлорпикрин не рассматривается как боевое ОВ. С другими ОВ хлорпикрин также в настоящее время не используется, поскольку его раздражающее действие практически сразу дало бы возможность обнаружить применение ОВ.
Благодаря раздражающему действию и простоте обращения хлорпикрин используется в качестве учебного (имитация газовой атаки) и проверочного (тестирование средств химзащиты) ОВ. Однако из-за того, что при нагревании хлорпикрин разлагается с образованием фосгена, применение его в качестве учебного ОВ требует соблюдения мер предосторожности. В связи с этим в настоящее время хлорпикрин как учебное ОВ постепенно заменяется другими ОВ раздражающего действия.
Ссылки
Примечания
- ↑ Whitacre David M. Reviews of Environmental Contamination and Toxicology /. — Springer. — ISBN 1441900276, 9781441900272
Боевые отравляющие вещества Общеядовитого действия Циановодород (AC) · Хлорциан (CK) · Арсин (SA) · Фосфин (PH) · Угарный газ (CO) Удушающего действия Фосген (CG) · Дифосген (DP) · Хлор (CL) Кожно-нарывного действия Иприт (HD) · Люизит (L) · Метилдихлорарсин (MD) · Этилдихлорарсин (ED) · Фенилдихлорарсин (PD) · Сесквииприт (Q) · Азотистые иприты (HN1, HN2, HN3) · Кислородный иприт (T) Нервно-паралитического действия V-агенты VE · VP · VS · VR · VM · VX · Амитон (VG) · EA 3148 G-агенты Табун (GA) · Зарин (GB) · Зоман (GD) · Циклозарин (GF) · Этилзарин (GE) · GV Раздражающего действия
(ирританты)Слезоточивые вещества
(лакриматоры)Хлорацетофенон (CN) · Хлорпикрин (PS) · Акролеин (DG) · Камит (CA) · Мартонит (BA) · Метилизоцианат Чихательные вещества
(стерниты)Адамсит (DM) · Дифенилхлорарсин (DA) · Дифенилцианарсин (DC) Комплексные Дибензоксазепин (CR) · Хлорбензальмалондинитрил (CS) Психохимического действия
(инкапаситанты)Хинуклидил-3-бензилат (BZ) · Фенциклидин (SN) · ЛСД (K) · Апоморфин · EA 3167 Болевого действия (алгогены) 1-метокси-1,3,5-циклогептатриен (CH) Метаболические яды
(цитотоксиканты)1,2-дихлорэтан · Оксид этилена · Полихлордибензодиоксины (ПХДД) · Полихлордибензофураны (ПХДФ) Категории:- Лакриматоры
- Химическое оружие
- Инсектициды
- Хлорорганические соединения
- Нитросоединения
- Фумиганты
- CH3NO2 + 3NaOCl
Wikimedia Foundation. 2010.
