- 1,2-дихлорэтан
-
1,2-дихлорэтан 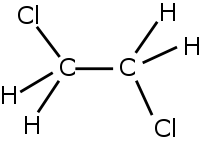

Общие Систематическое наименование 1,2-дихлорэтан Химическая формула C2H4Cl2 Физические свойства Состояние (ст. усл.) жидкость Молярная масса 98,96 г/моль Плотность 1,253 г/см³ Термические свойства Температура плавления -35 °C Температура кипения 83,5–84,0 °C Удельная теплота испарения 32,024 Дж/кг Удельная теплота плавления 8,837 Дж/кг Химические свойства Растворимость в воде 0,87 г/100 мл Структура Дипольный момент 1,80 Д Классификация Рег. номер CAS 107-06-2 SMILES ClCCCl Безопасность Токсичность очень токсично R-фразы R10, R16, R18, R33, R36/37/38, R39/26/28, R44, R45, R46, R48/21, R51/53, R55, R56, R57, R67 NFPA 704 1,2-дихлорэтан ClCH2—СН2Cl — хлорорганическое соединение, прозрачная бесцветная жидкость с сильным запахом похожим на запах хлороформа, практически не растворимая в воде. Хороший растворитель. Легко испаряется, образует азеотроп с водой (71, 5°С, 82,9 вес % дихлорэтана). 1,2-дихлорэтан относится к токсичным веществам.
Содержание
Производство
Каждый год в США, Западной Европе и Японии вместе взятых производится более 17,5 млн тонн дихлорэтана.[1] Основным методом получения является катализируемая хлоридом железа (III) реакция присоединения хлора к этилену.
Также существует метод, основанный на реакции этилена с хлороводородом и кислородом в присутствии катализатора на основе хлорида меди (II):
В принципе, он может также быть получен хлорированием этана или из этанола.
Химические свойства
При нагревании с водой, раствором соды или суспензией гашёной извести, дихлорэтан образует этиленгликоль;
действием щёлочи или пиролизом превращается в хлористый винил. При нагревании дихлорэтана с аммиаком под давлением даёт этилендиамин
с цианистым натрием дихлорэтан образует динитрил янтарной кислоты.
При нагревании с растворами полисульфидов натрия дихлорэтан образует каучукоподобное вещество - тиокол.
Реагирует с алюминием, а во влажном состоянии с цинком и железом.
Применение
Получение винилхлорида
Примерно 80 % производимого в мире дихлорэтана используется для получения винилхлорида, важного исходного соединения для синтеза полимерных материалов, в частности — поливинилхлорида.
Очистка в лаборатории
Промывают концетрированной серной кислотой, затем водой и перегоняют над пентаоксидом фосфора.
Другие применения
Используется в органическом синтезе в качестве прекурсора или растворителя, для извлечения жиров и алкалоидов, как инсектицид для обеззараживания зерна, зернохранилищ и почвы виноградников. Используется моделистами для склейки некоторых пластмасс (например оргстекла). Применялся в качестве антидетонационной присадки в топливо.
Безопасность
Дихлорэтан — сильное наркотическое средство, канцероген, при приёме внутрь или вдыхании паров вызывает отравление. Допустимая концентрация паров в воздухе производственных помещений 0, 01%. Дихлорэтан относят к легко воспламеняющимся жидкостям[2]. Пределы взрывчатости в воздухе 6, 20 — 15, 90 об. %. Взрывается при контакте с натрием. Экологически опасен и имеет период полураспада 50 лет. В качестве заменителя предлагается диоксан и толуол.
Примечания
- ↑ J.A. Field & R. Sierra-Alvarez (2004). «Biodegradability of chlorinated solvents and related chlorinated aliphatic compounds». Rev. Environ. Sci. Biotechnol. 3: 185–254. DOI:10.1007/s11157-004-4733-8.
- ↑ ГОСТ 1942-86: 1,2-Дихлорэтан технический. Технические условия. Проверено 25 декабря 2012.
Ссылки
 Категории:
Категории:- Хлорорганические соединения
- Инсектициды
- Продукция основного органического синтеза
- Галогенированные растворители
Wikimedia Foundation. 2010.








