- Фосфин
-
Фосфин 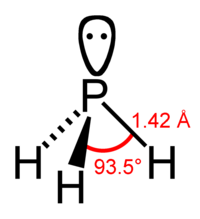
Общие Систематическое наименование Фосфин Химическая формула PH3 Физические свойства Состояние (ст. усл.) газ Отн. молек. масса 34.00 а. е. м. Молярная масса 34.00 г/моль Плотность 1.379 г/л, газ (25 °C) г/см³ Термические свойства Температура плавления – 133,8 °C Температура кипения – 87,8 °C Энтальпия образования (ст. усл.) 5,4 кДж/моль Химические свойства Растворимость в воде 31.2 мг/100 мл (17 °C) Классификация Рег. номер CAS [7803-51-2] Фосфи́н (фосфористый водород, гидрид фосфора, по номенклатуре IUPAC — фосфан РН3) — бесцветный, очень ядовитый, довольно неустойчивый газ (при нормальных условиях) со специфическим запахом гнилой рыбы.
Содержание
Физические свойства
Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0.142 нм, HPH = 93.5o). Дипольный момент составляет 0,58 D, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
Возможен синтез непосредственно из элементов:
Хлористый водород при нагревании взаимодействует с белым фосфором:
Разложение йодида фосфония:
Разложение фосфоновой кистоты:
или её восстановление:
Химические свойства
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
Проявляет сильные восстановительные свойства:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Соли фосфина, как и сам фосфин, являются сильными восстановителями.
Токсичность
Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу. В крови человека содержание фосфина не более 0,001 мг/м³.
Самовозгорание
Фосфин способен к самовозгоранию при контакте с кислородом воздуха. Может вызывать появление «блуждающих огней»[1][2].
Примечания
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
Категории:- Соединения фосфора
- Гидриды
Wikimedia Foundation. 2010.

















