- Арсин
-
Арсин 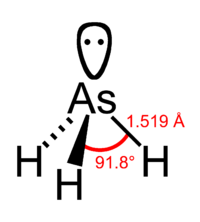


Общие Систематическое наименование арсин Химическая формула AsH3 Физические свойства Состояние (ст. усл.) бесцветный газ Отн. молек. масса 77.95 а. е. м. Молярная масса 77.95 г/моль Плотность 4.93 г/л, газ; 1.640 г/мл (−64 °C) г/см³ Термические свойства Температура плавления −117 (308.65 K) °C Температура кипения −62.5 °C Энтальпия образования (ст. усл.) +66.4 кДж/моль Химические свойства Растворимость в воде 0.07 г/100 мл Структура Дипольный момент 0.20 Д Классификация Рег. номер CAS 7784-42-1 Безопасность Токсичность 
Арси́н (мышьяковистый водород, гидрид мышьяка) — AsH3, гидрид мышьяка, химическое соединение мышьяка и водорода. При нормальных условиях - ядовитый бесцветный газ с чесночным запахом, обусловленным продуктами частичного окисления. Молекула арсина имеет форму тригональной пирамиды с атомом мышьяка в вершине. Низкое значение дипольного момента свидетельствует, что связь в молекуле арсина близка к неполярной и арсин практически не проявляет электронодонорные свойства. Так, ион арсония AsH4+, в отличие от его аналога иона аммония NH4+ неустойчив и был обнаружен лишь спектроскопически при пониженной температуре.
Содержание
Получение
В промышленности получают гидролизом арсенидов металлов (Mg, Zn и др.) кислотами или восстановлением соединений мышьяка водородом, взаимодействием галогенидов мышьяка с Li[AlH4], Na[BH4] или другими гидридами, например:
Химические свойства
- Арсин проявляет сильные восстановительные свойства, например, из раствора нитрата серебра он осаждает металлическое серебро:
- Арсин сравнительно нестоек и медленно разлагается даже при комнатной температуре на водород и элементарный мышьяк, при температуре 500 °C — мгновенно:
-
- При пропускании AsH3 через нагретую, наполненную водородом стеклянную трубку, металлический мышьяк отлагается на стенках трубки в виде черно-бурого зеркала. На этом свойстве арсина основана высокочувствительная качественная реакция на мышьяк — проба Марша.
- Не самовоспламеняется на воздухе и кислороде при комнатной температуре, но при нагревании на воздухе до 200 °C сгорает:
- С серой реагирует:
- Реагирует с концентрированой соляной кислотой c выделением водорода:
- Реагирует с растворами щелочных металлов в жидком аммиаке, проявляя кислотные свойства и образуя мышьяковистые производные, аналогичные амидам щелочных металлов:
- При нагревании арсина с металлами образуются арсениды.
Органические арсины
При взаимодействии хлорида мышьяка AsCl3 с диалкилцинком образуются соответствующие органические производные арсина, например, триметиларсин:
Это ядовитые жидкости с отвратительным запахом, проявляющие свойства ненасыщенных соединений.
Биологические свойства
Гидрид мышьяка является одним из самых сильных неорганических ядов. ПДК 0,0003 мг/л. Оказывает кроверазрушающее действие. При длительном и частом воздействии на организм может вызвать злокачественные новообразования.
Применение
Применяют AsH3 для легирования полупроводниковых материалов мышьяком, для получения As высокой чистоты.
Ссылки
- Арсины // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907. Статья Колотова С.С.
- Арсин на химик.ру
Категории:- Гидриды
- Соединения мышьяка
- Высокоопасные вещества
- Газы
-
Wikimedia Foundation. 2010.










