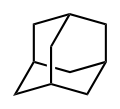
- Адамантан
-
Адамантан 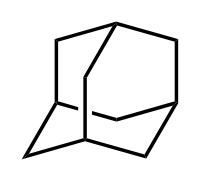
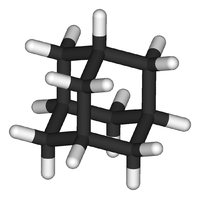
Общие Систематическое наименование Адамантан[1],
трицикло[3.3.1.13,7]деканХимическая формула C10H16 Физические свойства Молярная масса 136,23[2] г/моль Плотность 1,07[2] г/см³ Термические свойства Температура плавления 268[3] °C Энтальпия образования (ст. усл.) −197,2[4] кДж/моль Оптические свойства Показатель преломления 1,568[2] Классификация Рег. номер CAS 281-23-2 SMILES C1C2CC3CC1CC(C2)C3 Адаманта́н — химическое соединение, насыщенный трициклический мостиковый углеводород с формулой C10H16. Молекула адамантана состоит из трёх циклогексановых фрагментов, находящихся в конформации «кресло».[5] Пространственное расположение атомов углерода в молекуле адамантана повторяет расположение атомов в кристаллической решётке алмаза.[4] Этим фактом объясняется происхождение названия соединения, так как слово ἀδάμας — «несокрушимый» — является также греческим названием алмаза.[2] Уникальность молекулы адамантана заключается в том, что она является жёсткой и практически свободной от напряжений одновременно.[6] Открытие адамантана и изучение его свойств послужило импульсом к развитию одной из областей современной органической химии — химии органических полиэдранов.[7] Производные адамантана нашли практическое применение в качестве лекарственных препаратов, обладающих различной биологической активностью. На основе адамантана разработаны полимерные материалы и композиции с улучшенными эксплуатационными свойствами, термостабильные смазочные материалы.[7]
Содержание
История изучения
Впервые на возможность существования углеводорода состава C10H16 с алмазоподобным строением молекулы указывал Деккер (Decker H.) на конгрессе естествоиспытателей в Инсбруке в 1924 году[8]. Он даже выразил удивление тем фактом, что такой углеводород к тому времени ещё не был синтезирован.
Первая попытка синтезировать адамантан в лабораторных условиях была предпринята немецким химиком Гансом Меервейном, также в 1924 году. Он предположил, что адамантан образуется в результате реакции формальдегида с малоновым эфиром в присутствии пиперидина. Однако реализовать задуманное превращение Меервейну не удалось: вместо адамантана был получен тетраметиловый эфир бицикло[4,3,1]нонадион-2,6-тетракарбоновой-1,3,5,7 кислоты, который впоследствии получил название «эфир Меервейна». Хотя в целом эксперимент оказался неудачным, именно эфир Меервейна впоследствии использовался как исходное соединение в первых успешных синтезах адамантана и его производных.[7]
Другие исследователи предпринимали попытки синтезировать адамантан исходя из флороглюцина или некоторых производных циклогексанона, однако такие эксперименты оказались неудачными.[6]
Как индивидуальное химическое соединение адамантан был открыт чешскими химиками С. Ландой и В. Махачеком в 1933 году. Этот углеводород был выделен ими из нефти Годонинского месторождения.[9] Учёные получили всего несколько миллиграммов адамантана, структуру которого установили во многом благодаря аномально высокой температуре плавления.[6] Впоследствии адамантан был обнаружен и в других нефтяных месторождениях.
Первый успешный синтез адамантана удалось осуществить швейцарскому химику В. Прелогу в 1941 году.[10][11] Адамантан был получен из эфира Меервейна в пять стадий, при этом общий выход составил менее одного процента. Позднее Штеттером была предложена другая синтетическая схема, в результате чего выход адамантана был повышен до 6,5 %.[12][7]
Важным событием в истории изучения химии адамантана стало открытие, сделанное Шлейером и Дональдсоном в 1957 году. Учёными был разработан эффективный метод получения больших количеств этого углеводорода.[13] Эта работа сделала адамантан вполне доступным соединением, что послужило стимулом к активному изучению его физических и химических свойств.
Получение
Из природных источников
Единственный известный природный источник адамантана — нефть.[7][14] Содержание этого углеводорода в нефти составляет всего 0,0001—0,03 % (в зависимости от месторождения), вследствие чего такой способ получения адамантана является экономически невыгодным.
Помимо самого адамантана, в нефти присутствуют его многочисленные производные. Таких соединений известно более тридцати.[7] Выделение адамантана из сложной смеси углеводородов нефти возможно благодаря его уникальным физико-химическим свойствам, таким как высокая температура плавления, способность перегоняться с водяным паром и образовывать устойчивые аддукты с тиокарбамидом.
Синтетические
Первый успешный синтез адамантана из эфира Меервейна был осуществлён В. Прелогом в 1941 году. Синтез включал несколько стадий, а выход адамантана не превышал одного процента.
Этот метод уже не используется для синтеза адамантана в связи с высокой трудоёмкостью и низким выходом конечного продукта. Однако он имеет некоторую ценность в плане получения различных производных адамантана, в частности 1,3-адамантандикарбоновой кислоты.[6]
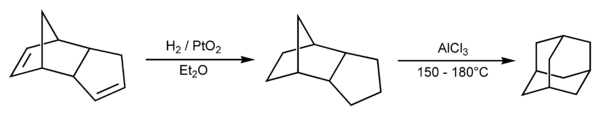
Для получения этого углеводорода в лабораторных условиях в настоящее время используют метод Шлейера. Димер циклопентадиена (который является вполне доступным соединением) подвергается каталитическому гидрированию, после чего изомеризуется в адамантан в присутствии катализатора — кислоты Льюиса. Методика, описанная в Organic Syntheses, предусматривает использования оксида платины в качестве катализатора гидрирования, а также хлорида алюминия в качестве катализатора изомеризации.[15] При этом выход составляет 13—15 %.
Адамантан является вполне доступным химическим соединением. Стоимость одного грамма у различных фирм-производителей не превышает одного доллара США.
Номенклатура
Согласно правилам систематической номенклатуры, адамантан следует называть трицикло[3.3.1.13,7]декан. Однако ИЮПАК рекомендует использовать название «адамантан» как более предпочтительное.[16]
Молекула адамантана обладает высокой симметрией. Вследствие этого 16 атомов водорода и 10 атомов углерода, образующие её, могут быть отнесены всего к двум типам.
Положения типа 1 называются узловыми, а положения типа 2 — мостиковыми. В молекуле адамантана насчитывается четыре узловых и шесть мостиковых положений.
Обычно 1-адамантильный заместитель в литературе традиционно обозначают символами «Ad—».
Ближайшими структурными аналогами адамантана являются норадамантан и гомоадамантан. Первый углеводород на одно CH2-звено меньше, а второй — больше, чем сам адамантан.
Физические свойства
Индивидуальное вещество
Химически чистый адамантан представляет собой бесцветное кристаллическое вещество, имеющее характерный камфорный запах.[4] Он практически нерастворим в воде, но зато легко растворяется в неполярных органических растворителях.[4] Адамантан имеет необычно высокую для углеводородов температуру плавления (268 °C), однако при этом медленно сублимирует уже при комнатной температуре.[2] Кроме того, он может перегоняться с водяным паром.[14]
Структурные свойства
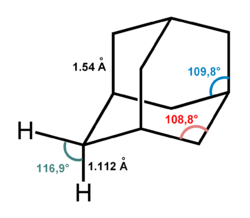
Молекула адамантана включает в себя три конденсированных циклогексановых кольца, находящихся в конформации «кресло». Параметры молекулы адамантана были определены методом дифракции электронов и рентгеновских лучей. Было установлено, что длина каждой связи «углерод — углерод» составляет 1,54 Å, а каждой связи «углерод — водород» — 1,112 Å.[2]
Молекула адамантана обладает высокой симметрией (точечная группа Td). Кристаллический адамантан существует в виде гранецентрированной кубической решётки (очень редкая для органических соединений пространственная группа
 , a = 9,426 ± 0,008 Å, четыре молекулы на ячейку).[6] При охлаждении этой формы до температуры ниже −65 °C наблюдается фазовый переход с образованием объёмно-центрированной тетрагональной решётки (a = 6,641 Å, c = 8,875 Å).[6][2]
, a = 9,426 ± 0,008 Å, четыре молекулы на ячейку).[6] При охлаждении этой формы до температуры ниже −65 °C наблюдается фазовый переход с образованием объёмно-центрированной тетрагональной решётки (a = 6,641 Å, c = 8,875 Å).[6][2]Спектральные свойства
В спектре ЯМР адамантана присутствуют два слабо разрешённых сигнала, которые соответствуют протонам, находящимся около мостиковых и узловых атомов углерода. В спектре 1H-ЯМР, записанном в CDCl3, сигналы протонов, расположенных возле узловых атомов углерода, наблюдаются при 1,873 м. д., а сигналы протонов при мостиковых атомах углерода — при 1,756 м. д. В спектре 13С-ЯМР сигналы узловых и мостиковых атомов углерода проявляются при 28,46 и 37,85 м. д. соответственно.[17]
Масс-спектры адамантана и его производных довольно характеристичны. Положение основного пика в масс-спектре адамантана обусловлено наличием в продуктах ионизации иона
 с соотношением m/z = 136. В результате фрагментации молекулярного иона обнаруживаются пики со значениями m/z равными 93, 80, 79, 67, 41, 39.[2][17]
с соотношением m/z = 136. В результате фрагментации молекулярного иона обнаруживаются пики со значениями m/z равными 93, 80, 79, 67, 41, 39.[2][17]ИК-спектр адамантана относительно прост ввиду высокой симметрии молекулы. Основные полосы поглощения и их соответствие различным типам колебаний приведены в таблице.[2]
Частота колебания, см−1 Форма колебания* 444 δ (CCC) 638 δ (CCC) 798 ν (C—C) 970 ρ (CH2), ν (C—C), δ (HCC) 1103 δ (HCC) 1312 ν (C—C), ω (CH2) 1356 δ (HCC), ω (CH2) 1458 δ (HCH) 2850 ν (C—H) в CH2 группах 2910 ν (C—H) в CH2 группах 2930 ν (C—H) в CH2 группах *Обозначения разных типов колебаний: δ — деформационное, ν — валентное, ρ, ω — деформационные колебания CH2 групп с выходом из плоскости. Оптическая активность
Молекулы адамантана, содержащие четыре разных заместителя при узловых атомах углерода, являются хиральными и оптически активными.[18] При этом центр хиральности, как и у оптически активных бифенилов, не приходится на какой-либо конкретный атом. R,S-номенклатура в этом случае может применяться так же легко.
Впервые такой вид оптической активности был описан в 1969 году двумя группами учёных.[19][20] Оптическая активность была обнаружена у адамантана, содержащего в узловых положениях четыре разных заместителя: водород, бром, метил и карбоксильную группу. Учёным удалось провести разделение энантиомеров этого соединения и продемонстрировать, что оптически активные адамантаны обладают очень маленькими значениями удельного вращения (обычно до 1°). Это можно объяснить большей удалённостью заместителей от центра хиральности, чем, к примеру, в случае асимметричного атома углерода.
Оптически активные адамантаны не нашли практического применения.
Химические свойства
Углеводороды, структура которых образована только σ-связями, отличаются химической инертностью. Однако, несмотря на это, адамантан и его производные весьма реакционноспособны. Это их свойство особенно ярко проявляется в реакциях ионного типа, которые протекают с образованием карбокатионов в качестве интермедиатов.
Адамантильные катионы
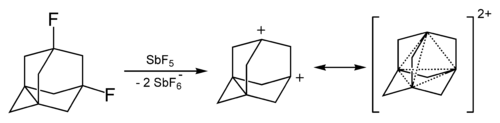
1-адамантил-катион обладает высокой стабильностью по сравнению с другими третичными карбокатионами. Он легко образуется в результате взаимодействия 1-фтор-адамантана с SbF5.[21]
Повышенная стабильность этого катиона связана с участием удалённых центров молекулы в делокализации заряда, подтверждением чего могут служить ЯМР-спектры соответствующих соединений. Как известно, наличие в молекуле положительно заряженного центра приводит к сдвигу сигналов тех атомов, которые взаимодействуют с ним, в слабое поле. Как видно из спектров ПМР, а особенно 13С, сигналы γ-углеродных атомов более дезэкранированы, хотя и расположены дальше от положительно заряженного центра. Первоначально причиной этого явления считали перекрывание вакантной орбитали положительно заряженного атома, с С-Н орбиталями в γ-положениях. Но расчёты показали, что для адамантана такое взаимодействие не может быть эффективным. Скорее всего стабильность катиона обусловлена взаимодействием вакантной орбитали с σ-орбиталями С(β)-С(γ) связей[22].
Дикатион адамантана был получен в растворах суперкислот. Он обладает повышенной стабильностью благодаря явлению, которое получило название «трёхмерная ароматичность».[23]
Адамантан является удобным модельным соединением для изучения карбокатионов и факторов, влияющих на их стабильность.
Реакции по узловым положениям
Наиболее реакционноспособными положениями молекулы адамантана являются узловые. Существует множество методов модификации по ним.
Бромирование
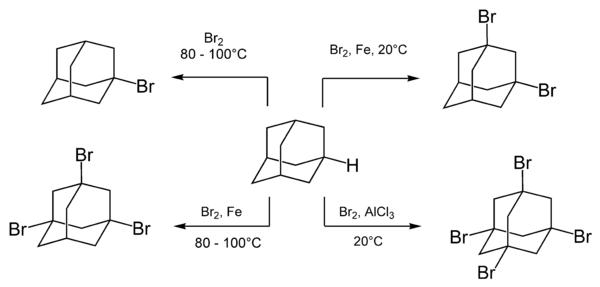
Адамантан легко вступает в реакцию с различными бромирующими реагентами, в первую очередь с молекулярным бромом. Состав и соотношение продуктов реакции могут быть различными и зависят от условий проведения реакции, в частности, наличия катализаторов.[7]
При кипячении адамантана с бромом образует монозамещённый продукт — 1-бромадамантан. При использовании в качестве катализаторов различных кислот Льюиса возможно образование двух-, трёх- или четырёхзамещённых бромадамантанов.[5]
Реакция бромирования протекает по ионному механизму с образованием адамантильного карбокатиона в качестве интермедиата. Это подтверждается, например, тем, что скорость реакции увеличивается в присутствии кислот Льюиса и не изменяется при облучении реакционной смеси или добавлении доноров свободных радикалов.[6]
Фторирование
Первые синтезы 1-фторадамантана были проведены с использованием 1-гидроксиадамантана[24] и производных 1-аминоадамантана в качестве исходных соединений. Позднее была описана реакция прямого фторирования адамантана.[25] Во всех перечисленных случаях генерировался адамантильный катион, который впоследствии взаимодействовал с фторсодержащим нуклеофилом.
Известна также реакция адамантана с газообразным фтором, в ходе которой образовывался 1-фторадамантан.[26]
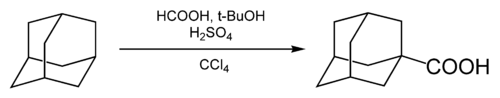
Карбоксилирование
В 1-е положение адамантана может быть введена карбоксильная группа.[27] Соответствующая реакция была впервые описана в 1960 году.[28] В качестве карбоксилирующего агента была использована муравьиная кислота, в качестве растворителя — тетрахлорид углерода.
Роль трет-бутанола и серной кислоты заключается в генерировании адамантильного катиона, который впоследствии подвергается карбонилированию моноксидом углерода, генерируемым in situ при взаимодействии муравьиной и серной кислот.[6] Выход 1-адамантанкарбоновой кислоты в препаративном варианте метода составляет 55—60 %.[27]
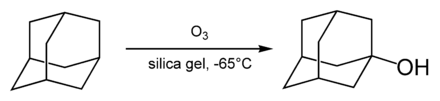
Гидроксилирование
Простейшим адамантановым спиртом является 1-гидроксиадамантан. Он достаточно легко образуется при гидролизе 1-бромадамантана в водном ацетоне. Кроме того, существует методика синтеза 1-гидроксиадамантана путём озонирования самого адамантана.[29]
Арилирование
Адамантан может взаимодействовать с бензолом в присутствии кислот Льюиса, в результате образуются продукты реакции Фриделя — Крафтса.[30]
Производные адамантана, содержащие ароматический заместитель при узловом атоме углерода, могут быть получены в ходе реакции электрофильного замещения из 1-гидроксиадамантана. В частности, реакция с анизолом протекает при нормальных условиях даже в отсутствие катализатора, что объясняется лёгкостью образования и высокой стабильностью адамантильного катиона.[5]
Прочие
Нитрование адамантана проходит с трудом и приводит к 1-нитроадамантану со средними выходами.[31]
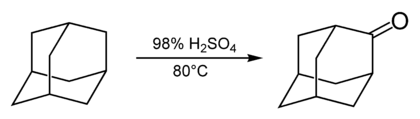
Реакции по мостиковым положениям
Мостиковые положения менее реакционноспособны, чем узловые, в связи с чем производные адамантана этого типа менее доступны. Важной реакцией, позволяющей получать производные этого типа, является взаимодействие адамантана с концентрированной серной кислотой, в результате чего образуется кетон — адамантанон.[32]
Наличие в адамантаноне карбонильной группы даёт возможность проводить дальнейшую модификацию по мостиковому положению путём взаимодействия этого соединения с нуклеофильными реагентами. Например, адамантанон служит исходным соединением для получения таких производных адамантана, как 2-адамантанкарбонитрил[33] и 2-метиладамантан.[34]
Применение
Адамантан как простое вещество не нашёл практического применения. Однако некоторые его производные успешно используются человеком в различных отраслях деятельности.[35]
В медицине
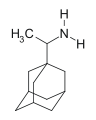
Первым производным адамантана, которое нашло применение в качестве лекарственного средства стал амантадин. Сначала он использовался как противовирусный препарат, эффективный в борьбе с вирусом гриппа А2 (1967 год). Позже был обнаружен его антипаркинсонический эффект.[36]
В отличие от L-допы — классического антипаркинсоника — амантадин действует быстрее, а побочное действие было сведено к минимуму. Высокая липофильность молекулы адамантана обеспечивает лёгкое проникновение лекарственного препарата сквозь гематоэнцефалический барьер. Кроме того, благодаря этому амантадин действует как спазмолитик.[36]
Среди других производных адамантана, являющихся действующими веществами лекарственных препаратов, можно назвать мемантин, римантадин, допамантин, тромантадин, вилдагриптин и кармантадин.
Полимерные аналоги адамантана запатентованы в качестве противовирусных препаратов, активных против ВИЧ.[37]
В технике
С помощью адамантана были получены алмазоподобные плёнки, которые в прочности всего в три раза уступают алмазу. Они образуются при воздействии на пары адамантана электрических разрядов. При нанесении таких плёнок на какую-либо поверхность увеличивается её твёрдость.[38] Некоторые алкильные производные адамантана нашли применение в качестве рабочей жидкости в гидравлических установках.[35]
Полимеры на основе адамантана предполагается использовать при изготовлении сенсорных покрытий для электронных дисплеев.[39] Потенциально возможным является применение адамантана и его гомологов в нанотехнологиях.[40]
Структурные аналоги
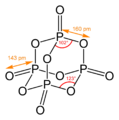
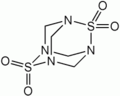
У адамантана есть ряд структурных аналогов среди неорганических и элементорганических соединений. К ним относятся оксид фосфора(V), сульфид фосфора(V), уротропин, а также некоторые другие соединения.
В 2005 году был синтезирован кремниевый аналог адамантана.[41]
См. также
Примечания
- ↑ Согласно рекомендациям ИЮПАК, название «адамантан» является предпочтительным и рекомендуется к использованию в номенклатуре.
- ↑ 1 2 3 4 5 6 7 8 9 Багрий Е. И. Особенности строения и свойств адамантанов // Адамантаны: Получение, свойства, применение. — М.: Наука, 1989. — С. 5—57. — 264 с. — ISBN 5-02-001382-x
- ↑ Потехин А. А. Свойства органических соединений. Справочник. — Л.: Химия, 1984. — С. 12—13. — 530 с.
- ↑ 1 2 3 4 Адамантан (рус.). Химическая энциклопедия. Архивировано из первоисточника 28 января 2012. Проверено 11 декабря 2009.
- ↑ 1 2 3 Несмеянов А. Н. Начала органической химии. — М.: Химия, 1969. — Т. 1. — С. 582—585. — 664 с.
- ↑ 1 2 3 4 5 6 7 8 Raymond C. Fort, Jr., and Paul Von R. Schleyers. (1964). «Adamantane: Consequences of Diamondoid Structure». Chem. Rev. 64 (3): 277—300. DOI:10.1021/cr60229a004.
- ↑ 1 2 3 4 5 6 7 Синтез производных адамантана (рус.). — Задача спецпрактикума для студентов IV курса кафедры химии нефти и органического катализа МГУ. Архивировано из первоисточника 28 января 2012. Проверено 11 декабря 2009.
- ↑ Decker H. (1924). «Versammlung deutscher Naturforscher und Ärzte. Innsbruck, 21.—27. September 1924». Angew. Chem. 37 (41): 795. DOI:10.1002/ange.19240374102.
- ↑ Landa, S.; Machácek, V. (1933). «». Collection Czech. Chem. Commun. 5: 1.
- ↑ Prelog, V., Seiwerth,R. (1941). «Über die Synthese des Adamantans». Berichte 74: 1644—1648. DOI:10.1002/cber.19410741004.
- ↑ Prelog, V., Seiwerth,R. (1941). «Über eine neue, ergiebigere Darstellung des Adamantans». Berichte 74: 1769—1772. DOI:10.1002/cber.19410741109.
- ↑ Stetter, H., Bander, O., and Neumann, W., Ber., 89, 1922 (1956).
- ↑ Schleyer, P. von R. (1957). «A Simple Preparation of Adamantane». J. Am. Chem. Soc. 79: 3292—3292. DOI:10.1021/ja01569a086.
- ↑ 1 2 Багрий Е. И. Методы получения углеводородов ряда адамантана // Адамантаны: Получение, свойства, применение. — М.: Наука, 1989. — С. 58—123. — 264 с. — ISBN 5-02-001382-x
- ↑ Adamantane. Organic Syntheses, Coll. Vol. 5, p. 16 (1973); Vol. 42, p. 8 (1962).
- ↑ IUPAC Preferred Names. Chapter 2, Sect 20—24 (англ.) (pdf). — рекомендации ИЮПАК по вопросам номенклатуры. Архивировано из первоисточника 28 января 2012. Проверено 10 ноября 2009.
- ↑ 1 2 Спектры ЯМР, ИК и МС адамантана можно найти в базе данных SDBS.
- ↑ Марч Дж. Органическая химия. Реакции, механизмы, структура. Углубленный курс для университетов и химических вузов. — М.: Мир, 1987. — Т. 1. — С. 137. — 381 с.
- ↑ J. Applequist, P. Rivers, D. E. Applequist. (1969). «Theoretical and experimental studies of optically active bridgehead-substituted adamantanes and related compounds». J. Am. Chem. Soc. 91 (21): 5705—5711.
- ↑ H. Hamill, M. A. McKervey. (1969). «The resolution of 3-methyl-5-bromoadamantanecarboxylic acid». Chem. Comm.: 864.
- ↑ Schleyer P. R., Fort R. C., Watts W. E. (1964). «Stable Carbonium Ions. VIII. The 1-Adamantyl Cation». J. Am. Chem. Soc. 86 (19): 4195—4197. DOI:10.1021/ja01073a058.
- ↑ George A. Olah, G. K. Surya Prakash, Joseph G. Shih, V. V. Krishnamurthy, Gheorge D. Mateescu, Gao Liang, Gyorgy Sipos, Volker Buss, Tamara M. Gund, Paul v. R. Schleyer. (1985). «Bridgehead adamantyl, diamantyl, and related cations and dications». J. Am. Chem. Soc. 107 (9): 2764—2772. DOI:10.1021/ja00295a032.
- ↑ Смит В., Бочков А., Кейпл Р. Органический синтез. Наука и искусство. — М.: Мир, 2001. — С. 387—392. — 573 с. — ISBN 5-03-003380-7
- ↑ Olah, George A. (1979). «Pyridinium poly(hydrogen fluoride): a convenient reagent for organic fluorination reactions». Journal of Organic Chemistry 44 (22): 3872—3881. DOI:10.1021/jo01336a027.
- ↑ Olah, George A. (1983). «Ionic fluorination of adamantane, diamantane, and triphenylmethane with nitrosyl tetrafluoroborate/pyridine polyhydrogen fluoride (PPHF)». Journal of Organic Chemistry 48 (19): 3356—3358. DOI:10.1021/jo00167a050.
- ↑ Rozen, Shlomo. (1988). «Direct synthesis of fluoro-bicyclic compounds with fluorine». Journal of Organic Chemistry 53 (12): 2803—2807.
- ↑ 1 2 1-Adamantanecarboxylic acid Organic Syntheses, Coll. Vol. 5, p. 20 (1973); Vol. 44, p. 1 (1964).
- ↑ H. Koch and W. Haaf, Angew. Chem., 72, 628 (1960).
- ↑ Tertiary alcohols from hydrocarbons by ozonation on silica gel: 1-adamantanol Organic Syntheses, Coll. Vol. 6, p. 43 (1988); Vol. 59, p. 176 (1979).
- ↑ Chalais, Stephane. (1985). «Direct clay-catalyzed Friedel-Crafts arylation and chlorination of the hydrocarbon adamantane». Helvetica Chimica Acta 68 (5): 1196—1203.
- ↑ George W. Smith, Harry D. Williams. (1961). «Some Reactions of Adamantane and Adamantane Derivatives». J. Org. Chem. 26 (7): 2207—2212. DOI:10.1021/jo01351a011.
- ↑ Adamantanone Organic Syntheses, Coll. Vol. 6, p. 48 (1988); Vol. 53, p. 8 (1973).
- ↑ 2-Adamantanecarbonitrile Organic Syntheses, Coll. Vol. 6, p. 41 (1988); Vol. 57, p. 8 (1977).
- ↑ Schleyer P. R., Nicholas R. D. (1961). «The Preparation and Reactivity of 2-Substituted Derivatives of Adamantane». J. Amer. Chem. Soc. 83 (1): 182—187. DOI:10.1021/ja01462a036.
- ↑ 1 2 Адамантан (рус.). Кругосвет. Архивировано из первоисточника 28 января 2012. Проверено 11 ноября 2009.
- ↑ 1 2 Ковтуненко В. О. Лікарські засоби з дією на центральну нервову систему. — Київ: Ірпінь: ВТФ «Перун», 1997. — С. 121, 123. — 464 с. — ISBN 966-569-170-8
- ↑ Boukrinskaia et al. Polymeric Adamantane Analogues (англ.) (pdf). — Патент США 5,880,154. Проверено 5 ноября 2009.
- ↑ Федосеев Д. В., Варшавская И. Г., Варнин В. П. // Журн. физ. химии 1987, Т. 61, № 1, С. 3070—3073.
- ↑ H. Y. Jeong. (2002). «Synthesis and characterization of the first adamantane-based poly(p-phenylenevinylene) derivative: an intelligent plastic for smart electronic displays». Thin Solid Films 417 (1—2): 171—174. DOI:10.1016/S0040-6090(02)00569-2.
- ↑ Hamid Ramezani and G. Ali Mansoori. (2007). «Diamondoids as Molecular Building Blocks for Nanotechnology». Topics in Applied Physics 109 (Molecular Building Blocks for Nanotechnology.): 44—71. DOI:10.1007/978-0-387-39938-6_4.
- ↑ Jelena Fischer, Judith Baumgartner, Christoph Marschner. (2005). «Synthesis and Structure of Sila-Adamantane». Science 310 (5749): 825. DOI:10.1126/science.1118981.

Портал «Наука» 
Адамантан в Викисловаре? 
Адамантан на Викискладе? 
Проект «Химия» Литература
- Багрий Е. И. Адамантаны: Получение, свойства, применение. — М.: Наука, 1989. — 264 с. — ISBN 5-02-001382-x
- Несмеянов А. Н. Начала органической химии. — М.: Химия, 1969. — Т. 1. — С. 582—585. — 664 с.
- Смит В., Бочков А., Кейпл Р. Органический синтез. Наука и искусство. — М.: Мир, 2001. — 573 с. — ISBN 5-03-003380-7
Ссылки
- Адамантан (рус.). Химическая энциклопедия. Архивировано из первоисточника 28 января 2012. Проверено 11 декабря 2009.
- Синтез производных адамантана (рус.). — Задача спецпрактикума для студентов IV курса кафедры химии нефти и органического катализа МГУ. Архивировано из первоисточника 28 января 2012. Проверено 11 декабря 2009.
- Механизм синтеза адамантана по П. Шлейеру (рус.). — flash-анимация. Архивировано из первоисточника 28 января 2012. Проверено 2010-15-07.
Каркасные углеводороды Трициклические Адамантан • Тетраэдран • Твистан 
Тетрациклические Призман Пентациклические Кубан • Кунеан Эта статья входит в число хороших статей русскоязычного раздела Википедии. Категория:- Углеводороды
Wikimedia Foundation. 2010.