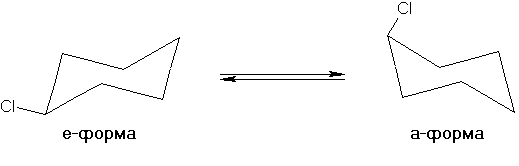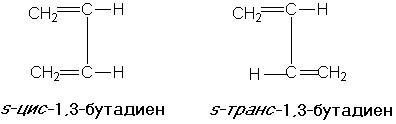- Энантиомеры
-
- Не следует путать с термином «Изомерия атомных ядер».
Изомери́я — (от izos - равный и meros — доля, часть греч., ср. изо-), существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по физическим и химическим свойствам. Такие соединения называются изомерами.
Содержание
Исторические сведения
В итоге полемики Ю. Либиха и Ф. Вёлера было установлено (1823), что существуют два резко различных по свойствам вещества состава AgCNO — циановокислое (AgNCO) и гремучее (AgONC) серебро. Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в 1830 ввел термин ИЗОМЕРИЯ и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (т. е. молекуле). Подлинное объяснение изомерия получила лишь во 2-й половине XIX в. на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
Структурная изомерия
Структурная изомерия — результат различий в химическом строении. К этому типу относят:
Изомерия углеводородной цепи (углеродного скелета)
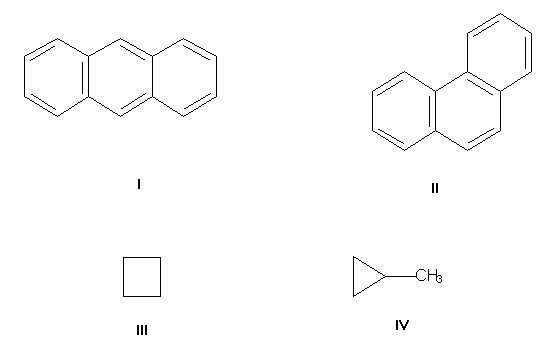
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3-СН2-СН2-СН3 и изобутан (СН3)3СН. Др. примеры: антрацен и фенантрен (формулы I и II соответственно), циклобутан и метилциклопропан (III и IV).
Валентная изомерия

Валентная изомерия (особый вид структурной изомерии), при которой изомеры можно перевести друг в друга лишь за счет перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен(VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
Изомерия функциональной группы
Различается характером функциональной группы. Пример: Этанол (CH3-CH2-OH) и Диметиловый эфир (CH3-O-CH3)
Изомерия положения
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или двойных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Пространственная изомерия (стереоизомерия)
Энантиомерия (оптическая изомерия)
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Этот тип изомеров подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с др. оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов - отнесение молекулы и одной из следующих точечных групп симметрии Cn, Dn, T, O, I (Хиральность). Чаще всего речь идет об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями, например:
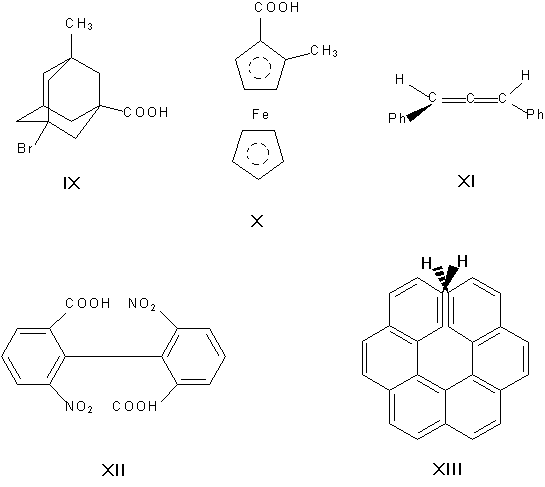
Асимметрическими могут быть и др. атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллен (XI), 6,6'-динитро-2,2'-дифеновая кислота (XII). Причина оптическое активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, гексагелицене (XIII).
(R)-, (S)- номенклатура оптических изомеров (правило наименования)
Четырём группам, присоединенным к ассиметрическому атому углерода Cabcd, приписывается различное старшинство, отвечающее последовательности: a>b>c>d. В простейшем случае старшинство устанавливается по порядковому номеру атома, присоединенного к ассиметрическому атому углерода: Br(35), Cl(17), S(16), O(8), N(7), C(6), H(1).
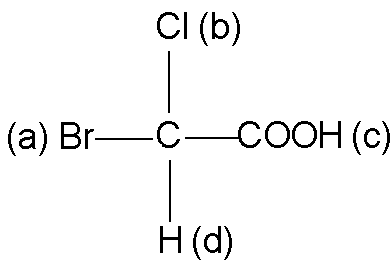
Например, в бромхлоруксусной кислоте:
Старшинство заместителей при ассиметрическом атоме углерода следующее: Br(a), Cl(b), C группы COOH (c), H(d).
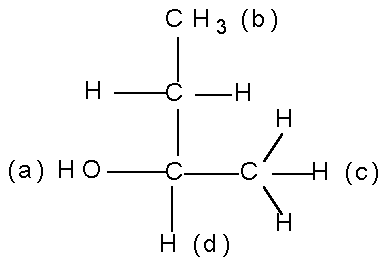
У бутанола-2 кислород является старшим заместителем (а), водород — младшим (d):
Требуется решить вопрос о заместителях CH3 и CH2CH3. В этом случае старшинство определяется порядковым номером или номерами других атомов в группе. Первенство остается за этильной группой, так как в ней первый атом С связан с другим атомом С(6) и с другими атомами Н(1), тогда как в метильной группе углерод соединен с тремя атомами Н с порядковым номером 1. В более сложных случаях продлжают сравнивать все атомы, пока не доходят до атомов с различными порядковыми номерами. Если имеются двойная или тройная связи, то находящиеся при них атомы считаются соответственно за два и за три атома. Так, группу —COH рассматривают как С (O, O, H), а группу —COOH — как С(О, О, ОН); карбоксильная группа старше альдегидной, поскольку содержит три атома с порядковым номером 8.
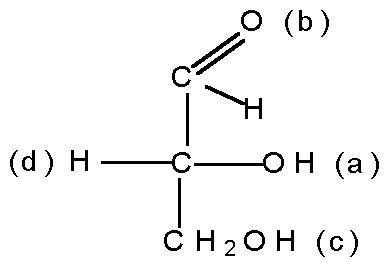
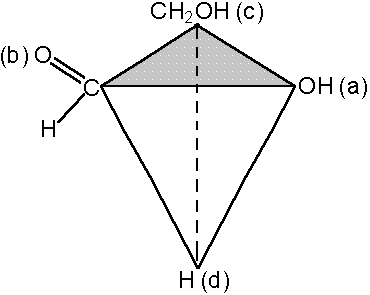
В D-глицериновом альдегиде старшей является группа ОН(а), затем следует CHO(b), CH2OH(c) и Н(d):
Следующий этап заключается в определении, является ли расположение групп правым, R (лат. rectus), или левым, S (лат. sinister). Переходя к соответствующей модели, её ориентируют так, чтобы младшая группа (d) в перспективной формуле оказалась внизу, и затем рассматривают сверху вдоль оси, проходящей через заштрихованную грань тетраэдра и группу (d). В D-глицириновом альдегиде группы
a→b→c→d
расположены в направлении правого вращения, и следовательно, он имеет R-конфигурацию:
(R)-глицериновый альдегид
В отличие от D,L номенклатуры обозначения (R)- и (S)- изомеров заключают в скобки.
Диастереомерия
σ—диастереомерия
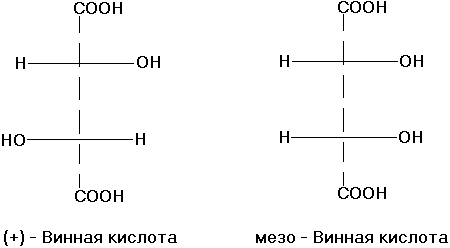
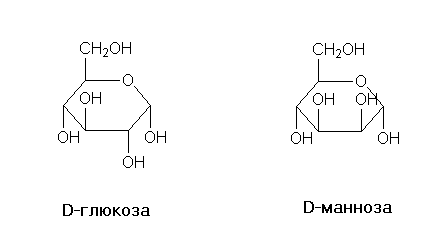
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ и π-диастереомеры. σ-диастериомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастериомеры являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
Для некоторых типов диастереомерия введены специальные обозначения, например трео- и эритро-изомеры — это диастереомерия с двумя асимметрическим атомами углерода и пространств, расположением заместителей у этих атомов, напоминающим соотвующую треозу (родственные заместители находятся по разные стороны в проекционных формулах Фишера) и эритрозу (заместители — по одну сторону):
Эритро-изомеры, которых асимметрические атомы связаны с одинаковыми заместителями, называются мезо-формами. Они, в отличие от остальных σ-диастереомеров, оптически неактивны из-за внутримолекулярной компенсации вкладов во вращение плоскости поляризации света двух одинаковых асимметрических центров противоположной конфигурации. Пары диастереомеров, различающиеся конфигурацией одного из нескольких асимметрических атомов, называются эпимерами, например:
Термин «аномеры» обозначает пару диастереомерных моносахаридов, различающихся конфигурацией гликозидного атома в циклической форме, например аномерны α-D- и β-D-глюкозы.
π—диастереомерия (геометрическая изомерия)
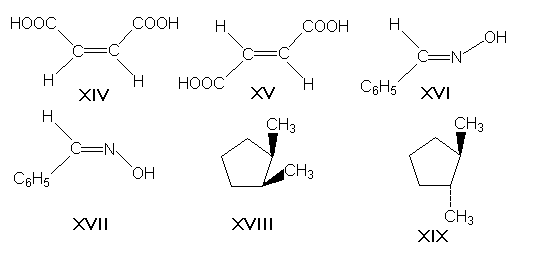
π-диастериомерами, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Конформеры. Таутомеры
Явление неразрывно связано с температурными условиями его наблюдения. Так, например, хлорциклогексан при комнатной температуре существует в виде равновесной смеси двух конформеров — с экваториальной и аксиальной ориентацией атома хлора:
Однако при минус 150 °С можно выделить индивидуальную а-форму, которая ведет себя в этих условиях как устойчивый изомер.
С др. стороны, соединения, в обычных условиях являющиеся изомерами, при повышении температуры могут оказаться находящимися в равновесии таутомерами. Например, 1-бромпропан и 2-бромпропан — структурные изомеры, однако при повышении температуры до 250 °С между ними устанавливается равновесие, характерное для таутомеров.
Изомеры, превращающиеся друг в друга при температуре ниже комнатной, можно рассматривать как нежесткие молекулы.
Существование конформеров иногда обозначают термином «поворотная изомерия». Среди диенов различают s-цис- и s-транс — изомеры, которые, по существу, являются конформерами, возникающими в результате вращения вокруг простой (s-single) связи:
Изомерия также характерна для координационных соединений. Так, изомерны соединения, различающиеся по способу координации лигандов (ионизационная изомерия), например, изомерны:
[Co(NH3)5Br]+SO4- и [Co(NH3)5SO4]+Br-
Здесь, по существу, имеется аналогия со структурной изомерии органических соединений.
Химические превращения, в результате которых структурные изомеры превращаются друг в друга, называется изомеризацией. Такие процессы имеют важное значение в промышленности. Так, например, проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для последующего дегидрирования в изопрен. Изомеризацией являются и внутримолекулярной перегруппировки, из которых большое значение имеет, например, превращение оксима циклогексанона в капролактам - сырье для производства капрона.
Процесс взаимопревращения энантиомеров называется рацемизацией: она приводит к исчезновению оптической активности в результате образования эквимолярной смеси (—)- и (+)-форм, то есть рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в которой преобладает термодинамически более устойчивая форма. В случае π-диастереомеров — обычно транс-форма. Взаимопревращение конформационных изомеров называется конформационным равновесием.
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов более 500 (известно из них около 70), пространств, изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы. Для обозначения пространств, изомеров разных типов разработана номенклатура стереохимическая, собранная в разделе Е Номенклатурных правил ИЮПАК по химии.
Литература
- Физер Л., Физер М., Органическая химия. Углубленный курс. т.1. пер с англ., Под ред. д.х.н. Н.С. Вульфсона. Изд. «Химия». М., 1969.
- Пальм В. А., Введение в теоретическую органическую химию, М., 1974;
- Соколов В И., Введение в теоретическую стереохимию, М., 1979;
- Сланина 3., Теоретические аспекты явления изомерии в химии, пер. с чеш., М., 1984;
- Потапов В М., Стереохимия М., 1988.
См. также
- Таутомерия
- Хиральность
- Асимметрический атом
- Модели орбиталей
- Раскристаллизация энантиомеров
Структурная химия Химическая связь: Ароматичность | Ковалентная связь | Ионная связь | Металлическая связь | Водородная связь | Донорно-акцепторная связь | Таутомерия Отображение структуры: Функциональная группа | Структурная формула | Химическая формула | Лиганд Электронные свойства: Электроотрицательность | Сродство к электрону | Энергия ионизации | Диполь | Правило октета Стереохимия: Асимметрический атом | Изомерия | Конфигурация | Хиральность | Конформация
Wikimedia Foundation. 2010.