- Дистилляция
-
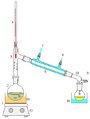
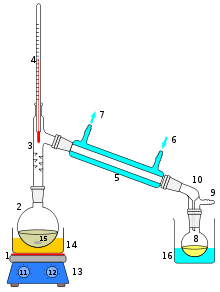 Устройство простейшего перегонного аппарата.
Устройство простейшего перегонного аппарата.
1 Нагревательный элемент
2 Перегонный куб
3 Отводная трубка или насадка Вюрца
4 Термометр
5 Холодильник
6 Подвод охлаждающей жидкости
7 Отвод охлаждающей жидкости
8 Приёмная колба
9 Отвод газа (в том числе с понижением давления)
10 Аллонж
11 Регулятор температуры нагревателя
12 Регулятор скорости перемешивания
13 Магнитная мешалка
14 Водяная (масляная, песочная и т. п.) баня
15 Мешалка или "кипелки"
16 Охлаждающая ваннаДистилляция (лат. distillatio — стекание каплями) — перегонка, испарение жидкости с последующим охлаждением и конденсацией паров. Различают дистилляцию с конденсацией пара в жидкость (при которой получаемый конденсат имеет усреднённый состав вследствие перемешивания) и дистилляцию с конденсацией пара в твёрдую фазу (при которой в конденсате возникает распределение концентрации компонентов). Продуктом дистилляции является конденсат или остаток (или и то, и другое) – в зависимости от дистиллируемого вещества и целей процесса. Основными деталями дистилляционного устройства являются обогреваемый контейнер (куб) для дистиллируемой жидкости, охлаждаемый конденсатор (холодильник) и соединяющий их обогреваемый паропровод.
История
До X века, у Авиценны дистилляция упоминается как метод получения эфирных масел.
Применение
Дистилляция применяется в промышленности и в лабораторной практике для разделения и рафинирования сложных веществ: для разделения смесей органических веществ (например, разделение нефти на бензин, керосин, соляр и др.; получение ароматических веществ в парфюмерии; получение алкогольного спирта) и для получения высокочистых неорганических веществ (например, металлов: бериллий, цинк, магний, кадмий и др.).
Теория
В теории дистилляции в первую очередь рассматриваются двухкомпонентные вещества. Действие дистилляции основано на том, что концентрация
 некоторого компонента в жидкости отличается от его концентрации
некоторого компонента в жидкости отличается от его концентрации  в паре, образующемся из этой жидкости. Отношение
в паре, образующемся из этой жидкости. Отношение  =
= является характеристикой процесса и называется коэффициентом разделения при дистилляции. Коэффициент разделения зависит от природы разделяемых компонентов и режима дистилляции.
является характеристикой процесса и называется коэффициентом разделения при дистилляции. Коэффициент разделения зависит от природы разделяемых компонентов и режима дистилляции.Режимы дистилляции характеризуются температурой испарения и степенью отклонения от фазового равновесия жидкость-пар. Обычно в дистилляционном процессе n=
 +
+ , где n - число частиц вещества, переходящих в единицу времени из жидкости в пар,
, где n - число частиц вещества, переходящих в единицу времени из жидкости в пар,  - число частиц, возвращающихся в это же время из пара в жидкость,
- число частиц, возвращающихся в это же время из пара в жидкость,  - число частиц, переходящих в это время в конденсат. Отношение
- число частиц, переходящих в это время в конденсат. Отношение  /n является показателем отклонения процесса от равновесного. Предельными являются режимы, в которых
/n является показателем отклонения процесса от равновесного. Предельными являются режимы, в которых  =0 (равновесное состояние системы жидкость-пар) и
=0 (равновесное состояние системы жидкость-пар) и  =n (режим молекулярной дистилляции).
=n (режим молекулярной дистилляции).При
 =0, когда число частиц, покидающих в единицу времени жидкость, равно числу частиц, возвращающихся в это же время в жидкость, равновесный коэффициент разделения двухкомпонентного вещества может быть выражен через давления
=0, когда число частиц, покидающих в единицу времени жидкость, равно числу частиц, возвращающихся в это же время в жидкость, равновесный коэффициент разделения двухкомпонентного вещества может быть выражен через давления  и
и  чистых компонентов при температуре процесса:
чистых компонентов при температуре процесса:  , где
, где  и
и  - так называемые коэффициенты активности, учитывающие взаимодействие компонентов в жидкости. Эти коэффициенты имеют температурную и концентрационную зависимости (см. активность (химия)). С понижением температуры значение коэффициента разделения обычно удаляется от единицы, т. е. эффективность разделения при этом увеличивается.
- так называемые коэффициенты активности, учитывающие взаимодействие компонентов в жидкости. Эти коэффициенты имеют температурную и концентрационную зависимости (см. активность (химия)). С понижением температуры значение коэффициента разделения обычно удаляется от единицы, т. е. эффективность разделения при этом увеличивается.При
 =n все испаряющиеся частицы переходят в конденсат (режим молекулярной дистилляции). В этом режиме коэффициент разделения
=n все испаряющиеся частицы переходят в конденсат (режим молекулярной дистилляции). В этом режиме коэффициент разделения  , где
, где  и
и  - молекулярные массы первого и второго компонентов соответственно. Режим молекулярной дистилляции может применяться в различных дистилляционных способах, включая ректификацию. Обычно молекулярная дистилляция осуществляется в вакууме при низком давлении пара и при близком расположении поверхности конденсации к поверхности испарения (что исключает столкновение частиц пара друг с другом и с частицами атмосферы). В режиме, близком к молекулярной дистилляции, проводится дистилляция металлов. В связи с тем, что коэффициент разделения при молекулярной дистилляции зависит не только от парциальных давлений компонентов, но и от их молекулярных (или атомных) масс, молекулярная дистилляция может применяться для разделения смесей, для которых
- молекулярные массы первого и второго компонентов соответственно. Режим молекулярной дистилляции может применяться в различных дистилляционных способах, включая ректификацию. Обычно молекулярная дистилляция осуществляется в вакууме при низком давлении пара и при близком расположении поверхности конденсации к поверхности испарения (что исключает столкновение частиц пара друг с другом и с частицами атмосферы). В режиме, близком к молекулярной дистилляции, проводится дистилляция металлов. В связи с тем, что коэффициент разделения при молекулярной дистилляции зависит не только от парциальных давлений компонентов, но и от их молекулярных (или атомных) масс, молекулярная дистилляция может применяться для разделения смесей, для которых  , - азеотропных смесей, включая смеси изотопов.
, - азеотропных смесей, включая смеси изотопов.Для различных режимов дистилляции выведены уравнения, связывающие содержание второго компонента в конденсате
 и в остатке
и в остатке  с долей перегонки
с долей перегонки  или с долей остатка
или с долей остатка  при заданных условиях процесса и известной начальной концентрации
при заданных условиях процесса и известной начальной концентрации  жидкости (
жидкости ( ,
,  и
и  - масса конденсата и остатка, а также начальная масса дистиллируемого вещества соответственно). Расчёты проводятся в предположении идеального перемешивания дистиллируемой жидкости, а также жидкого конденсата. Также выведены уравнения распределения компонентов в твёрдом конденсате, получаемого дистилляцией с направленным затвердеванием конденсата или зонной дистилляцией. Параметром этих уравнений является коэффициент разделения α для заданных условий дистилляции.
- масса конденсата и остатка, а также начальная масса дистиллируемого вещества соответственно). Расчёты проводятся в предположении идеального перемешивания дистиллируемой жидкости, а также жидкого конденсата. Также выведены уравнения распределения компонентов в твёрдом конденсате, получаемого дистилляцией с направленным затвердеванием конденсата или зонной дистилляцией. Параметром этих уравнений является коэффициент разделения α для заданных условий дистилляции.При дистилляции вещества с большой концентрацией компонентов с конденсацией пара в жидкость при несильной зависимости коэффициентов активности компонентов от их концентраций взаимосвязь величин
 ,
,  и
и  , когда используются концентрации в процентах, имеет вид:
, когда используются концентрации в процентах, имеет вид:
 .
.Для дистилляции с конденсацией пара в жидкость при малом содержании примеси
 ,
, =
= .
.Дистилляционные уравнения могут использоваться для описания процессов распределения примесей в других фазовых переходах из фазы с интенсивным перемешиванием (таких как переходы жидкий кристалл-кристалл, жидкий кристалл-жидкость, газ-плазма, а также в переходах, связанных с квантово-механическими состояниями – сверхтекучая жидкость, конденсат Бозе-Эйнштейна) – при подстановке в них соответствующих коэффициентов распределения.
Дистилляция с конденсацией пара в жидкость (простая перегонка, фракционная дистилляция, ректификация)
Простая перегонка — частичное испарение жидкой смеси путём непрерывного отвода и конденсации образовавшихся паров в холодильнике. Полученный конденсат называется дистиллятом, а неиспарившаяся жидкость — кубовым остатком.
Фракционная дистилляция (или дробная перегонка) — разделение многокомпонентных жидких смесей на отличающиеся по составу части — фракции путём сбора конденсата частями с различной летучестью, начиная с первой, обогащенной низкокипящим компонентом. Остаток жидкости обогащён высококипящим компонентом. Для улучшения разделения фракций применяют дефлегматор.
Ректификация — способ дистилляции, при котором часть жидкого конденсата (флегма) постоянно возвращается в куб, двигаясь навстречу пару в контакте с ним. В результате этого примеси, содержащиеся в паре, частично переходят во флегму и возвращаются в куб, при этом чистота пара (и конденсата) повышается (См. ректификация, ректификационная колонна).
Дистилляция с конденсацией пара в твёрдую фазу (с конденсацией пара в градиенте температуры; с направленным затвердеванием конденсата; зонная дистилляция)
Дистилляция с конденсацией пара в градиенте температуры – дистилляционный процесс, в котором конденсация в твёрдую фазу осуществляется на поверхности, имеющей градиент температуры, с многократным реиспарением частиц пара. Менее летучие компоненты осаждаются при более высоких температурах. В результате в конденсате возникает распределение примесей вдоль температурного градиента, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Разделение компонентов пара при реиспарении подчиняется собственным закономерностям. Так, при молекулярной дистиляции соотношение между количествами
 и
и  осаждённых в конденсаторе первого и второго компонентов, соответственно, выражается равенством:
осаждённых в конденсаторе первого и второго компонентов, соответственно, выражается равенством: ,
,где
 и
и  - скорости испарения первого компонента из расплава и с поверхности реиспарения соответственно,
- скорости испарения первого компонента из расплава и с поверхности реиспарения соответственно,  и
и  - то же для второго компонента,
- то же для второго компонента,  и
и  - коэффициенты конденсации первого и второго компонентов соответственно, μ – коэффициент, зависящий от поверхности испарения и углов испарения и реиспарения. Реиспарение повышает эффективность очистки от трудноудаляемых малолетучих примесей в 2-5 раз, а от легколетучих - на порядок и более (по сравнению с простой перегонкой). Этот вид дистилляции нашёл применение в промышленном производстве высокочистого бериллия.
- коэффициенты конденсации первого и второго компонентов соответственно, μ – коэффициент, зависящий от поверхности испарения и углов испарения и реиспарения. Реиспарение повышает эффективность очистки от трудноудаляемых малолетучих примесей в 2-5 раз, а от легколетучих - на порядок и более (по сравнению с простой перегонкой). Этот вид дистилляции нашёл применение в промышленном производстве высокочистого бериллия.Дистилляция с направленным затвердеванием конденсата (дистилляция с вытягиванием дистиллята) – дистилляционный процесс в контейнере удлинённой формы c полным расплавлением дистиллируемого вещества и конденсацией пара в твёрдую фазу по мере вытягивания конденсата в холодную область. Процесс разработан теоретически.
В получаемом конденсате возникает неравномерное распределение примесей, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Процесс является дистилляционным аналогом нормальной направленной кристаллизации. Распределение примеси в конденсате описывается уравнением:
 ,
,где С – концентрация примеси в дистилляте на расстоянии х от начала, L – высота конденсата при полностью испарившемся дистиллируемом материале.
Зонная дистилляция - дистилляционный процесс в контейнере удлинённой формы c частичным расплавлением рафинируемого вещества в перемещаемой жидкой зоне и конденсацией пара в твёрдую фазу по мере выхода конденсата в холодную область. Процесс разработан теоретически.
При движении зонного нагревателя вдоль контейнера сверху вниз в контейнере формируется твёрдый конденсат с неравномерным распределением примесей, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Процесс может быть повторён многократно, для чего конденсат, полученный в предыдущем процессе, должен быть перемещён (без переворота) в нижнюю часть контейнера на место рафинируемого вещества. Неравномерность распределения примесей в конденсате (т. е. эффективность очистки) растёт с увеличением числа повторений процесса.
Зонная дистилляция является дистилляционным аналогом зонной перекристаллизации. Распределение примесей в конденсате описывается известными уравнениями зонной перекристаллизации с заданным числом проходов зоны – при замене коэффициента распределения k для кристаллизации на коэффициент разделения α для дистилляции. Так, после одного прохода зоны

 ,
,где С – концентрация примеси в конденсате на расстоянии х от начала конденсата, λ – длина жидкой зоны.
См. также
Литература
- Девятых Г.Г., Еллиев Ю.Е. Введение в теорию глубокой очистки веществ. - М.: Наука, 1981. - 320 с.
- Девятых Г.Г., Еллиев Ю.Е. Глубокая очистка веществ. - М.: Высшая школа, 1974. - 180 с.
- Степин Б.Д., Горштейн И.Г., Блюм Г.З., Курдюмов Г.М., Оглоблина И.П. Методы получения особо чистых неорганических веществ. - Л.: Химия, 1969. - 480 с.
- Корякин Ю.В., Ангелов И.И. Чистые химические вещества. Руководство по приготовлению неорганических реактивов и препаратов в лабораторных условиях. - М.: Химия, 1974. - с.
- Беляев А.И. Физико-химические основы очиски металлов и полупроводниковых веществ. - М.: Металлургия, 1973. - 320 с.
- Пазухин В.А., Фишер А.Я. Разделение и рафинирование металлов в вакууме. - М.: Металлургия, 1969. - 204 с.
- Иванов В.Е., Папиров И.И., Тихинский Г.Ф., Амоненко В.М. Чистые и сверхчистые металлы (получение методом дистилляции в вакууме). - М.: Металлургия, 1965. - 263 с.
- Несмеянов А.Н. Давление пара химических элементов. - М.: Издательство АН СССР, 1961 - 320 с.
- Кравченко А.И. О временной зависимости состава двойного сплава при его разгонке в вакууме // Известия АН СССР. Серия: Металлы. - 1983. - № 3. - С. 61-63.
- Кравченко А.И. Об уравнениях дистилляции при малом содержании примеси // Вопросы атомной науки и техники, 1990. — № 1 — Серия: «Ядерно-физические исследования» (9). — С. 29-30.
- Нисельсон Л.Я., Ярошевский А.Г. Межфазовые коэффициенты распределения (Равновесия кристалл-жидкость и жидкость-пар). - М.: Наука, 1992. - 399 с.
- Kravchenko A.I. Simple substances refining: efficiency of distillation methods // Functional Materials, 2000 - V.7. - N. 2. - P. 315-318.
- Кравченко А.И. Уравнение распределения примеси в твёрдом дистилляте // Неорганические материалы, 2007. - Т. 43. - № 8. - С. 1021-1022.
- Кравченко А.И. Эффективность очистки в дистилляционном и кристаллизационном процессах // Неорганические материалы, 2010. - Т. 46. - № 1. - С. 99-101.
- Кравченко А.И. Дистилляция с вытягиванием дистиллята // Вопросы атомной науки и техники, 2008. — № 1 — Серия: «Вакуум, чистые материалы, сверхпроводники» (17). — С. 18-19. [1]
- Кравченко А.И. Зонная дистилляция // Вопросы атомной науки и техники, 2011. — № 6 — Серия: «Вакуум, чистые материалы, сверхпроводники» (19). — С. 24-26. [2]
- Кравченко А.И. О распределении примесей при фазовых переходах из фазы с идеальным перемешиванием // Вопросы атомной науки и техники, 2011. — № 6 — Серия: «Вакуум, чистые материалы, сверхпроводники» (19). — С. 27-29. [3]
- ГОСТ 2177 (ASTM D86)
Галерея

Для улучшения этой статьи желательно?: - Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Химические методы разделения Дефлегмация | Дистилляция | Зонная плавка | Многократное испарение | Однократное испарение | Постепенное испарение | Рефлюкс (химия) | Твердофазная экстракция | Фракционированная конденсация | Хроматография | Электролиз | Экстракция Дистилляция Теория Закон Рауля · Закон Дальтона · Законы Коновалова · Теоретическая тарелка · Парциальное давление 
В промышленности Ректификационная колонна В лаборатории Роторный испаритель Разновидности Сухая перегонка · Вакуум-дистилляция · Паровая дистилляция Категории:- Лабораторная техника
- Методы разделения
- Химическая технология
- Эфирные масла
- Водоподготовка
Wikimedia Foundation. 2010.