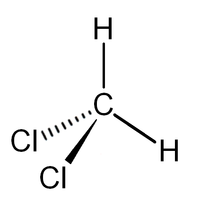
- Хлористый метилен
-
Дихлорметан 
Общие Систематическое наименование дихлорметан Сокращения ДХМ Традиционные названия дихлорметан, метилен хлористый Химическая формула CH2Cl2 Эмпирическая формула CH2Cl2 Молярная масса 84.9 г/моль Физические свойства Плотность вещества 1.3266 г/см³ Примеси хлорметаны Состояние (ст. усл.) подвижная прозрачная жидкость Термические свойства Температура плавления -96.7 °C Температура кипения 40 °C Температура вспышки 14 °C Критическая точка 245 Энтальпия (ст. усл.) -87.86 кДж/моль Удельная теплота парообразования 336,4 Дж/кг Давление пара 470 Химические свойства Растворимость в воде 20 г/100 мл Оптические свойства Показатель преломления 1,4242 Классификация номер CAS 75-09-2 RTECS PA8050000 Дихлорметан (хлористый метилен, ДХМ, CH2Cl2) — прозрачная лекгоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °С при соотношении равном 5:1
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцей. После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Практически не растворим в воде(20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °С), образует азеотропную смесь с водой (т.кип. 38,1 °С, 98,5% М.). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористым углеродом. С йодом при 200 °С дает СН2l2, с бромом при 25-30 °С в присут. алюминия - бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым растворо NH3 до 100-125 °С образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °С приводит к метиламину,муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlСl3 метиленхлорид вступает в реакцию Фриделя - Крафтса, например с бензолом образует дифенилметан. [1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворитель для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Очистка в лаборатории
- Промывают кислотой, щелочью и водой. Сушат над поташом и перегоняют. Можно использовать молекулярные сита 4А.[2]
- Кипячение с фосфорным ангидридом с последующей перегонкой. Хранится над молекулярными ситами 3А.
Специализированные применения
Используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Вытяжная вентиляция необходима. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В тоже время не было отмечено какого либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
В Евросоюзе запрещены краски с дихлорметаном, как для личного пользования так и для профессонального применения. Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые. Не вводить в контакт с щелочными металлами из-за угрозы взрыва. ПДК в рабочей зоне 50мг/м3, в воде водоёмов не более 7.5 мг/л
КПВ 12-22%
Общая безопасность и методы устранения аварий[3]
Примечания
- ↑ Химическая энциклопедия Т3, М 1988, стр 60-61
- ↑ Органикум Т2, М 1992, стр 411
- ↑ http://www.safework.ru/ilo/ICSC/cards/view/?0058
Wikimedia Foundation. 2010.