- Нитробензол
-
Нитробензол 
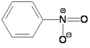
Общие сведения Синонимы Нитробензол
мирабановое масло (устар.)Химическая формула C6H5NO2 SMILES [O-][N+](=O)c1ccccc1 Молярная масса 123.06 г/моль Внешний вид бесцветная или зеленовато-жёлтая маслянистая жидкость номер CAS [98-95-3] Свойства Плотность 1.199 г/см3 Растворимость в воде 0.19 г/100 мл (20 °C) Температура плавления 5.85 °C Температура кипения 210.9 °C ПДК 3 мг/м3 MSDS Данные MSDS Классификация ЕС Токсичен (T)
Carc. Cat. 3
Repr. Cat. 3
Опасен для
окружающей среды (N)NFPA 704 


R-phrases — обозначения риска R23/24/25, R40,
R48/23/24, R51/53, R62S-phrases — обозначения хранения (S1/2), S28, S36/37,
S45, S61Твспышки 88 °C Т самовоспламенения 525 °C RTECS номер QJ0525000 Supplementary data page Спектральные данные УФ, ИК, NMR, MS — масс-спектральные данные Related compounds Родственные соединения Анилин
Бензол
НитрозобензолДанные приведены для
стандартного состояния (25 °C, 100 kPa), если не отмечено иное
Infobox disclaimer and referencesНитробензол — токсичное органическое вещество, имеющее миндальный запах. Формула C6H5NO2. Внешний вид — ярко-желтые кристаллы или маслянистая жидкость, нерастворимая в воде.
Содержание
Применение
Исходное сырьё в производстве анилина, ароматических азотсодержащих соединений (бензидин, хинолин, азобензол), растворитель эфиров целлюлозы, компонент полировальных составов для металлов. Применяется как растворитель и мягкий окислитель. В основном используется как полупродукт для производства анилина.
Получение
В промышленности нитробензол получают непрерывным нитрованием бензола смесью концентрированых H2SO4 и HNO3 с выходом 96—99 %.
В лабораторных условиях нитробензол получают нитрованием бензола смесью H2SO4 (1,84 г/см3) и HNO3 (1,4 г/см3) в соотношении 1:1 при 55—60 °C (45 мин). Выход целевого продукта достигает 80 %.
Химические свойства
Электрофильное замещение
В связи с сильным электроноакцепторным действием нитрогруппы реакции электрофильного замещения идут в мета-положение и скорость реакции ниже чем у бензола.
- Нитрование. Образуется смесь изомеров: 93 % м-динитробензола, 6,5 % о-динитробензола и 0,5 % п-динитробензола.
- Сульфирование.
- Галогенирование.
Восстановление
Наиболее важной реакцией ароматических нитросоединений является восстановление их до первичных аминов.
Эта реакция была открыта в 1842 году Н. Н. Зининым, который впервые восстановил нитробензол до анилина действием сульфида аммония. В настоящее время для восстановления нитрогруппы в аренах до аминогруппы в промышленных условиях применяется каталитическое гидрирование. В качестве катализатора используют медь на силикагеле в качестве носителя. Катализатор готовят нанесением карбоната меди из суспензии в растворе силиката натрия и последующим восстановлением водородом при нагревании. Выход анилина над этим катализатором составляет 98 %.
Иногда в промышленном гидрировании нитробензола до анилина в качестве катализатора используют никель в комбинации с оксидами ванадия и алюминия. Такой катализатор эффективен в интервале 250—300° и легко регенерируется при окислении воздухом. Выход анилина и других аминов составляет 97—98 %. Восстановление нитросоединений до аминов может сопровождаться гидрированием бензольного кольца. По этой причине для получения ароматических аминов избегают использовать в качестве катализаторов платину, палладий или никель Ренея.
В промышленности анилин получают каталитическим восстановлением нитробензола на медном или никелевом катализаторе, который вытеснил старинный способ восстановления нитробензола чугунными стружками в водном растворе хлорного железа и соляной кислоты.
Восстановление нитрогруппы до аминогруппы сульфидом и гидросульфидом натрия в настоящее время имеет значение только для частичного восстановления одной из двух нитрогрупп, например, в м-динитробензоле или 2,4-динитроанилине.
При ступенчатом восстановлении полинитросоединений с помощью сульфида натрия этот неорганический реагент превращается в тетрасульфид натрия, что сопровождается образованием щелочи.
Высокая щелочность среды приводит к образованию азокси- и азосоединений в качестве побочных продуктов. Для того чтобы избежать этого в качестве восстановителя следует использовать гидросульфид натрия, где щелочь не образуется.
Токсичность
Впитывается через кожу, оказывает сильное действие на ЦНС, нарушает обмен веществ, вызывает заболевания печени, окисляет гемоглобин в метгемоглобин
Ссылки
- International Chemical Safety Card 0065 (англ.)
- NIOSH Pocket Guide to Chemical Hazards (англ.)
- IARC Monograph: «Nitrobenzene» (англ.)
- US EPA factsheet (англ.)
- Механизм восстановления нитробензола цинком в щелочной среде и железом в соляной кислоте (реакция Бешама) (англ.)
Литература
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
Категории:- Нитросоединения
- Растворители
- Канцерогены группы IARC 2B
- Продукция основного органического синтеза
Wikimedia Foundation. 2010.
