- Тиосульфаты
-
Тиосульфа́ты — соли и сложные эфиры тиосерной кислоты, H2S2O3. Тиосульфаты неустойчивы, поэтому в природе не встречаются. Наиболее широкое применение имеют тиосульфат натрия и тиосульфат аммония.
Существуют также органические тиосульфаты.
Содержание
История открытия и исследования
Органические тиосульфаты были исследованы немецким химиком Гансом Бунте в 1872 году[1] в его докторской диссертации.
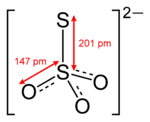
Строение
Тиосульфат-ион по строению близок к сульфат-иону. В тетраэдре [SO3S]2− связь S-S (1.97А) длиннее, чем связи S-O (1.48А).
Физические свойства
Растворимость в воде (г/100 г):
- K2S2O3 200,1 (35 °C), 233,4 (56 °C)
- (NH4)2S2O3 150 (20 °C)
- MgS2O3 49,8 (20 °C)
- CaS2O3 42,9 (10 °C)
- SrS2O3 15,3 (10 °C)
- BaS2O3 0,2 (0 °C)
- Tl2S2O3 0,18 (25 °C)
- PbS2O3 0,02 (18 °C)
Образуют кристаллогидраты, при нагревании которых происходит плавление, представляющее собой растворение тиосульфатов в кристаллизационной воде.
- К2S2O3·5Н2О — температура плавления 35,0 °C
- К2S2O3·3Н2О — температура плавления 56,1 °C
- K2S2O3·H2О — температура плавления 78,3 °C, плотность 2,590 г/см3
- MgS2O3·6H2O — температура плавления выше 82 °C, плотность 1,818 г/см³
- CaS2O3·6H2O — температура плавления выше 40 °C, плотность 1,872 г/см³
Получение
Тиосульфаты получаются при взаимодействии растворов сульфитов с сероводородом:
При кипячении растворов сульфитов с серой:
При окислении полисульфидов кислородом воздуха:
Химические свойства
Тиосерная кислота H2S2O3 в присутствии воды разлагается:
поэтому её выделение из водного раствора невозможно. Свободная тиосерная кислота может быть получена при взаимодействии хлорсульфоновой кислоты с сероводородом при низкой температуре:
Выше 0 °C свободная тиосерная кислота необратимо разлагается по вышеприведённой реакции.
Благодаря наличию серы в степени окисления −2 тиосульфат-ион обладает восстановительными свойствами. Слабыми окислителями (I2, Fe3+) тиосульфаты окисляются до тетратионатов:
Более сильные окислители окисляют тиосульфаты до сульфатов:
Сильные восстановители восстанавливают тиосульфат-ион до сульфида, например:
Тиосульфат-ион также является сильным комплексообразователем:
Так как тиосульфат-ион координируется с металлами через атом серы в степени окисления −2, в кислой среде тиосульфатные комплексы легко переходят в сульфиды:
Из-за наличия атомов серы в разных степенях окисления в кислой среде тиосульфаты склонны к реакциям конпропорционирования:
Применение
Тиосульфаты используются в:
- фотографии
- аналитической и органической химии
- горнорудной промышленности
- текстильной и целлюлозно-бумажной промышленности
- пищевой промышленности
- медицине
Фотография
Использование тиосульфата натрия в фотографии в качестве фиксажа основана на способности тиосульфат-иона переводить нерастворимые в воде светочувствительные галогениды серебра в растворимые несветочувствительные комплексы:
Фиксажи условно делятся на нейтральные, кислые, дубящие и быстрые.
Нейтральный фиксаж представляет собой раствор тиосульфата натрия в воде (250 г/л). Для более быстрого прекращения действия проявляющих веществ, занесённых из проявителя в эмульсионном слое во избежание появления вуали на изображении фиксирование обычно проводят в слабокислой среде. В качестве подкислителей используют серную и уксусную кислоты, а также гидросульфит или метабисульфит (K2S2O5) калия.
Для упрочнения эмульсионного слоя используют дубящие фиксажи. В качестве дубящих веществ в разных рецептурах могут использоваться тетраборат натрия (бура), борная кислота (одновременно как подкислитель), хромокалиевые или алюмокалиевые квасцы и формалин.
Скорость реакции комплексообразованя уменьшается от AgCl к AgI, поэтому при использовании бромсеребряных и иодсеребряных фотоматериалов используются быстрые фиксажи на основе тиосульфата аммония. Ускорение процесса фиксирования происходит за счёт промежуточной стадии—быстро протекающего образования аммиачного комплекса серебра:
Из-за гигроскопичности тиосульфата аммония обычно применяют смесь тиосульфата натрия и хлорида аммония.
Химия
В аналитической химии тиосульфат натрия используется в качестве реагента в иодометрии. Его использование основано на реакции окисления тиосульфат-иона иодом до тетратионата:
Растворы тиосульфата натрия нестабильны из-за взаимодействия с углекислым газом, содержащемся в воздухе и растворённом в воде:
и вследствие окисления кислородом воздуха:
и в результате контаминации растворов тионовыми бактериями, которые окисляют тиосульфаты до сульфатов, осуществляя хемосинтез. Поэтому приготовление раствора тиосульфата натрия из навески нецелесообразно. Обычно готовят раствор приблизительной концентрации и устанавливают точную концентрацию титрованием раствором бихромата калия или иода.
При идометрическом титровании применяют метод обратного титрования, то есть прибавляют избыток раствора иодида калия точной концентрации, а затем титруют образовавшийся иод раствором тиосульфата натрия..
Горнорудная промышленность
В горнорудной промышленности тиосульфат натрия используется для извлечения серебра и золота из руд и минералов как альтернатива цианидному выщелачиванию
Процесс тиосульфатного выщелачивания основан на окислении золота и серебра кислородом воздуха в присутствии тиосульфата натрия (тиосульфатное выщелачивание):
в кислой среде или двухвалентной медью:
в щелочной среде (тиосульфатно-аммиачное выщелачивание).
Аналогичные процессы происходят и при выщелачивании серебра.
Преимуществами тиосульфатно-аммиачного выщелачивания перед цианидным является отсутствие необходимости в использовании высокотоксичных реагентов, а также более полное извлечение металлов из руд, содержащих большие количества меди и марганца. При тиосульфатно-аммиачном выщелачивании в рабочий раствор добавляют серу и сульфит аммония, что позволяет обеспечить извлечение золота до 50 — 95 %
Текстильная промышленность
После отбеливания тканей хлором их обрабатывают тиосульфатом натрия для удаления следов хлора и придания прочности:
Пищевая промышленность
В пищевой промышленности тиосульфат натрия применяется как пищевая добавка Е539 (регулятор кислотности).
Медицина
В медицине тиосульфат натрия используется:
- как антидот при отравлениях тяжёлыми металлами (ртуть, свинец, мышьяк), цианидами, солями иода и брома, а также при детоксикации больных с алкогольными психозами;
- при лечении аллергических заболеваний, артрита и невралгии;
- при лечении кожных заболеваний (чесотка, псориаз).
См. также
Примечания
Литература
- Спиридонов Ф. М., Зломанов В. П. 13.1 Тиосерная кислота и тиосульфаты // Химия халькогенов. Учебное пособие. — М.: МГУ, 2000.
- Пилипенко А. Т., Пятницкий И. В. Иодометрия // Аналитическая химия. — М.: Химия, 1990. — С. 417-421. — 848 с. — ISBN 5-7245-0507-X
- Аренс В. Ж. Геотехнологические методы добычи полезных ископаемых. — М.: Недра, 1975. — Т. 3. — С. 245-254. — 480 с.
- Фиксирование проявленных изображений
- Спиридонов Ф. М., Зломанов В. П. Химия халькогенов
- Ю. Ю. Лурье Справочник по аналитической химии. М.: Химия, 1979
- Пилипенко А. Т., Пятницкий И. В. Аналитическая химия. М: Химия, 1990
- Аренс В. Ж. Геотехнологические методы добычи полезных ископаемых. — М.: Недра, 1975
Пищевые добавкиПищевые красители E1xx | Консерванты E2xx | Антиокислители и регуляторы кислотности E3xx | Стабилизаторы, загустители и эмульгаторы E4xx | Регуляторы рН и вещества против слёживания E5xx | Усилители вкуса и аромата, ароматизаторы E6xx | Антибиотики E7xx | Резерв E8xx | Прочие E9xx | Дополнительные вещества E1xxx
Прочие: Воск (E900—909) • Глазурь (E910—919) • Восстановитель (E920—929) • Газ для упаковки (E930—949) • Заменители сахара (E950—969) • Вспениватель (E990—999)
Категории:- Тиосульфаты
- Пищевые добавки
Wikimedia Foundation. 2010.











![\mathsf{3S_2O_3^{2-} + 8Al + 14OH^- + 9H_2O \rightarrow 6S^{2-} + 8[Al(OH)_4]^-}](e2b3487b4307bebbae26402130fee995.png)
![\mathsf{Ag^+ + 2S_2O_3^{2-} \rightarrow [Ag(S_2O_3)_2]^{3-}}](0c7dff0444d177718a79e840f4899ee5.png)
![\mathsf{2[Ag(S_2O_3)_2]^{3-} + 6H^+ \rightarrow Ag_2S\downarrow + 3S + 3SO_2 + H_2SO_4 + 2H_2O}](3c1bec3cd59956576c5eabd0df0aef32.png)

![\mathsf{AgHal + 2S_2O_3^{2-} \rightarrow [Ag(S_2O_3)_2]^{3-} + Hal^-}](6f7b777ee94c679009f36be7aa99ebf7.png)
![\mathsf{AgHal + 2NH_4^+ + 2OH^- \rightarrow [Ag(NH_3)_2]^- + H_2O + Hal^-}](02b456f6cff504c770fffa26b3a9ef5b.png)



![\mathsf{4Au + O_2 + 8S_2O_3^{2-} + 4H^+ \rightarrow 4[Au(S_2O_3)_2]^{3-} + 2H_2O}](2a3637bb661620d10061989b93192de0.png)
![\mathsf{Au + 5S_2O_3^{2-} + [Cu(NH_3)_4]^{2+} \rightarrow [Au(S_2O_3)_2]^{3-} + 4NH_3 + [Cu(S_2O_3)_3]^{5-}}](8095a0e41935c8565e705f2c55b7396f.png)
