- Метаналь
-
Формальдегид 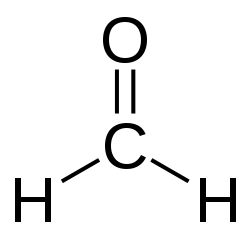
Общие Другие названия Муравьиный альдегид
МетанальМолекулярная формула CH2O Молярная масса 30,03 г/моль Вид газ с острым запахом Свойства Плотность 0,9151 г/см³ (при −80 °C) Растворимость в воде до 37% Температура плавления −92 °C Температура кипения −19,2 °C (в др. источниках, −19,3 °C) Опасность Описание Обладает токсичными,
канцерогенными свойствами
Оказывает сильное влияние на ЦНС
Опасен для окружающей средыКатегория взрывоопасности II B Группа взрывоопасности Т2 Концентрационные пределы воспламенения 7-73% об. Температура самовоспламенения 435 °C Термодинамические свойства Ст. энтальпия образования ΔH −115,9 кДж/моль (г) Ст. энергия Гиббса образования ΔG −110 кДж/моль (г) Ст. энтропия образования S 218,66 Дж/моль·K (г) Ст. мольная теплоёмкость Cp 35,35 Дж/моль·K (г) Энтальпия кипения ΔHкип 23,3 кДж/моль Если не указано другое, параметры даны для 25 °C, 100 кПа Формальдегид (от лат. formica — муравей), рекомендуемое международное название метаналь, устаревшее — муравьиный альдегид (CH2=O) — газообразное бесцветное вещество с острым запахом, первый член гомологического ряда алифатических альдегидов.
Содержание
Токсические свойства
Обладает токсичностью, негативно воздействует на генетический материал, репродуктивные органы, дыхательные пути, глаза, кожный покров. Оказывает сильное действие на центральную нервную систему.
Предельно допустимая концентрация (ПДК) формальдегида в воздухе:
- ПДКм.р. = 0,5 мг/м³
- ПДКс.с. = 0,003 мг/м³
Смертельная доза 35 % водного раствора формальдегида (формалина) составляет 10 — 50 г.
Канцерогенность
Формальдегид внесен в список канцерогенных веществ[1][2][3].
Получение
Основной способ получения формальдегида — окисление метанола:
2CH3OH + O2 → 2HCHO + 2H2OОкисление метанола в формальдегид проводится с использованием серебряного катализатора при температуре 650 °C и атмосферном давлении. Это хорошо освоенный технологический процесс, и 80 % формальдегида получается именно по этому методу. Недавно разработан более перспективный способ, основанный на использовании железо-молибденовых катализаторов. При этом реакция проводится при 300 °C. В обоих процессах степень превращения составляет 99 %.
Процесс дегидрирования метанола, осуществленный на цинк-медных катализаторах при 600 °C, пока не получил широкого развития, однако он является очень перспективным, поскольку позволяет получать формальдегид, не содержащий воды.
Существует также промышленный способ получения формальдегида окислением метана:
CH4 + O2 → HCHO + H2OПроцесс проводят при температуре 450 °C и давлении 1—2 МПа, в качестве катализатора применяется фосфат алюминия AlPO4
Применение
Водный раствор формальдегида — формалин — свёртывает белки, поэтому он применяется для дубления желатина при производстве кинофотоплёнки, для консервации биологических материалов (создание анатомических и других биомоделей), а также как антисептик.
Формальдегид широко применяется при изготовлении пластмасс (таких, как фенопласт и аминопласты), искусственных волокон, из него получают пентаэритрит (сырьё для производства взрывчатых веществ и пластификаторов), триметилопропан. Основная часть формальдегида идет на изготовление древесностружечных материалов, где он используется для получения карбамидной смолы.
Также формальдегид широко используется в качестве консерванта в различных вакцинах, вводимых человеку, последствия чего до сих пор не изучены.
Примечания
- ↑ "Перечень веществ, продуктов, производственных процессов, бытовых и природных факторов, канцерогенных для человека", Приложение 2 к нормативам ГН 1.1.725-98 от 23 декабря 1998 г. N 32]
- ↑ Этот же перечень, Лаборатория аналитической экотоксикологии института проблем экологии и эволюции им. А.Н. Северцова РАН
- ↑ Территориальное управление Роспотребнадзора по Тульской области
См. также
- Formaldehyde(en)
- Канцероген
- ПДК
Ссылки
Альдегиды Формальдегид · Ацетальдегид · Пропаналь · Бутаналь · Акролеин · Кротоновый альдегид · Бензальдегид · Салициловый альдегид · Фурфурол
Wikimedia Foundation. 2010.
