- Диоксан
-
Диоксан 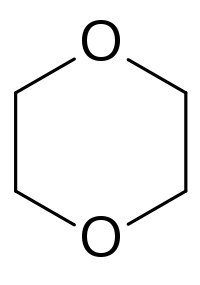
Общие Систематическое наименование 1,4-диоксан Традиционные названия диоксан Эмпирическая формула C4H8O2 Физические свойства Состояние (ст. усл.) жидкость Примеси образует перекиси Молярная масса 88,11 г/моль Плотность 1,033 г/см³ Термические свойства Температура плавления 12 °C Температура кипения 101 °C Температура вспышки 5 °C Энтальпия образования (ст. усл.) 354 кДж/моль Химические свойства Растворимость в воде смешивается г/100 мл Растворимость в спирт смешивается г/100 мл Растворимость в эфир смешивается г/100 мл Оптические свойства Показатель преломления 1,42241 Классификация Рег. номер CAS 123-91-1 SMILES C1OCCOC1 Регистрационный номер EC 204-661-8 Безопасность ЛД50 5170 мг/кг Диоксан — циклическое химическое соединение с формулой C4H8O2. Традиционно под диоксаном понимается 1,4-диоксан (диэтилендиоксид), циклический простой эфир, хотя существуют также 1,2-диоксан и 1,3-диоксан.
Диоксан применяется в органической химии в качестве полярного апротонного растворителя. В основном используется как стабилизатор 1,1,1-трихлорэтана. Имеет сладковатый запах схожий с запахом диэтилового эфира. Диоксан побочный продукт этоксилирования в производстве материалов для косметики, а именно натрий лаурил сульфата. По Proposition 65 в Калифорнии диоксан признан канцерогеном[1].
Содержание
Свойства
Бесцветная подвижная жидкость с эфирным запахом; tпл 11,8 °C, tkип 101,3 °C, плотность 1,03375 г/см³; показатель преломления n20D 1,42241; tвсп 5 °C (в закрытой чашке); пределы взрываемости в воздухе 1,97—22,5 % (по объёму). Диоксан смешивается с водой, спиртом, эфиром; образует с водой азеотропную смесь (tkип 87,8 °C, 81,6 % диоксана).
Получение и структура
В промышленности диоксан получают из этиленгликоля (1), из хлорекса (2) и из окиси этилена (3):

Молекула центросимметрична, означая что она принимает конформацию «кресла», типичной для производных циклогексана. Молекула конформационно подвижная и может легко принять конформацию «ванны» необходимую для хелатирования катионов металлов. В 1985 мировое производство имело величину около 11,000 — 14,000 тонн.
Очистка и сушка
При стоянии диоксан образует пероксиды, поэтому нельзя его сушить КОН до их удаления.
При перемешивании и взбалтывании осторожно смешивают диоксан с 5 об. % концентрированной серной кислоты, затем смесь кипятят с обратным холодильником 2 ч. После охлаждения при энергичном встряхивании добавляют твердый гидроксид калия (обычно внешнее охлаждение не обязательно), оставляют до разрушения гранул КОН; эту операцию повторяют до тех пор, пока свежий КОН будет сохранять свою форму в течение ночи. Диоксан фильтруют, добавляют нарезанный небольшими кусочками натрий и вновь кипятят с обратным холодильником, пока капельки натрия не перестанут реагировать (останутся блестящими). После перегонки (осторожно! Кристаллизующийся диоксан может забить охлаждаемый водой холодильник!) добавляют натриевую проволоку.
Применение
Диоксан применяют во многих производствах как хороший растворитель, например для ацетилцеллюлозы, минеральных и растительных масел, красок. Диоксан в основном используется как стабилизатор для 1,1,1-трихлорэтана для хранения и транспортирования в алюминиевых контейнерах. Обычно алюминий защищён пассивирующим слоем оксида алюминия, но когда эти слои нарушены, высокореакционноспособный алюминий контактирует с хлоруглеводородами. Так алюминий реагирует с 1,1,1-трихлорэтаном, образуя алюминия хлорид, который катализирует дегидрогалогенирования оставшегося 1,1,1-трихлорэтана в винилиден хлорид и хлороводород. Отражая свойство диоксана как лиганда, он «отравляет» алюминия хлорид, образуя комплекс.
Свойство растворителя
Диоксан — относительно малополярный растворитель, он имеет большую растворяющую способность, чем диэтиловый эфир. Диэтиловый эфир плохо растворим в воде, диоксан, напротив, смешивается с ним, более того, он гигроскопичен. Он — многофункциональный апротонный растворитель. Атом кислорода — основание Льюиса, поэтому способен сольватировать многие неорганические соединения. Из-за низкой токсичности, его иногда замещают тетрагидрофураном в некоторых процессах. Однако, он имеет большую температуру кипения (101 °C против 66 °C для ТГФ), что важно когда реакция должна вестись при высокой температуре. Кислородные центры являются основанием Льюиса и так диоксан служит как хелатирующий лиганд. Он реагирует с реагентом Гриньяра выпадая в виде магния галида. Таким путём, диоксан используется для смещения равновесия Шленка. Диметилмагний получается таким образом:
- 2 CH3MgBr + (C2H4O)2 → MgBr2(C2H4O)2 + (CH3)2Mg
Диоксан используется в качестве стандарта для ПМР-спектроскопии в D2O.
Безопасность
Диоксан сравнительно токсичен — ЛД50 5170 мг/кг. Предельно допустимая концентрация его в воздухе 0,01 мг/л. Раздражает глаза и дыхательный тракт. Подозревается в способности поражать центральную нервную систему, печень и почки. Случайное воздействие на рабочих 1,4-диоксана привело к смертельным исходам. Диоксан классифицируют IARC как Group 2B канцероген: возможно канцерогенен для людей, так как известно, что он канцерогенен для животных. Как и другие простые эфиры, диоксан соединяется с атмосферным кислородом при стоянии, образуя взрывоопасные пероксиды. Взрывоопасны смеси с воздухом, КПВ содержит 1,97— 25 об. % диоксана
Воздействие на природу
Диоксан на уровне 1 мкг/л был обнаружен в некоторых местах в США.[2] Он малотоксичен для водных форм жизни и биодеградирует различными путями.[3] Диоксан попадает в подземные источники воды. Проблема обостряется из-за высокой растворимости диоксана в воде, он не задерживается почвой и попадает в подземные воды. Он устойчив к существующим процессам биодеградации. В результате пятно заражения больше чем у обычных растворителей.[4]
Изомеры 1,4-диоксана
1,2-Диоксан является типичным циклическим пероксидом. Образуется при действии пероксида водорода на бис-метилсульфонат 1,4-бутандиола. Гидрирование 1,2-диоксана приводит к 1,4-бутандиолу, его щелочной или кислотный гидролиз - к 4-гидроксимасляному альдегиду.
1,3-Диоксан относится к числу циклических ацеталей.
Примечания
- ↑ «Proposition 65 List of Chemicals» (PDF). Office of Environmental Health Hazard Assessment. 1,4-Dioxane cancer 123-91-1 January 1, 1988.
- ↑ 1, 4-Dioxane Fact Sheet: Support Document. OPPT Chemical Fact Sheets. United States Environmental Protection Agency (February 1995). Архивировано из первоисточника 21 февраля 2012.
- ↑ M. Kinne, M. Poraj-Kobielska, S. A. Ralph, R. Ullrich, M. Hofrichter, K. E. Hammel «Oxidative cleavage of diverse ethers by an extracellular fungal peroxygenase» J. Biol. Chem. 2009, volume 284, pp. 29343-9.
- ↑ Crawford, Scott. "Down N' Dirty With 1,4-Dioxane.". XDD, LLC's Xpert Solutions Newsletter (Fall 2007/Winter 2008). Архивировано из первоисточника 21 февраля 2012. Проверено 16 января 2008.
Литература
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5

Для улучшения этой статьи желательно?: - Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Добавить иллюстрации.
- Исправить статью согласно стилистическим правилам Википедии.
Кислородсодержащие гетероциклы Трёхчленные Оксиран · Диоксиран Четырёхчленные Оксетан · Оксетанон (β-лактон) Пятичленные Фуран · Дигидрофуран · Тетрагидрофуран · Бензофуран · Изобензофуран · Диоксолан · Тетрагидрофуранон (γ-лактон) Шестичленные Пиран · Дигидропиран · Тетрагидропиран · Диоксан · Тетрагидропиранон (δ-лактон) Семичленные Капролактон (ε-лактон) Категории:- Циклические простые эфиры
- Кислородсодержащие гетероциклы
- Растворители
Wikimedia Foundation. 2010.
