- Теллурид ртути
-
Теллурид ртути 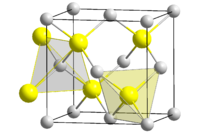
Кристалличесая структура
HgTe типа сфалеритаСистематическое название Теллурид ртути(II)
Другие названия Теллурид ртути
Химическая формула HgTe
Эмпирическая формула Hg1−XTe1+X,
X = 0—0,1Внешний вид кубические кристаллы
почти черного цветаСвойства Молярная масса Температура плавления 610±1 °C
Температура кипения разл.
Температура разложения 850 °C
Плотность 8,12 г/см³
Относительная диэлектрическая проницаемость 20,8
Теплопроводность 2.7 Вт/(м·K)
Коэффициент линейного расширения 5.2×10−61/K
Структура Кристаллическая решётка Кубическая,
типа цинковой обманки
пространственная группа F-43mКоординационное число 4
Классификация Регистрационный номер CAS 12068-90-5
Регистрационный номер EC PubChem Код SMILES [Te]=[Hg]
Код InChI InChI=1S/Hg.Te
Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). Теллурид ртути — бинарное неорганическое соединение ртути (Hg) и теллура (Te) с формулой HgTe, полуметалл, с нулевой шириной запрещённой зоны при 0 К. Проявляет свойства топологической изоляции. В природе встречается в виде редкого минерала колорадоита.
Содержание
Свойства теллурида ртути
Общие
Теллурид ртути является бинарным соединением, образующимся при взаимодействии эквиатомномых количеств ртути и теллура. У устойчивой кристаллической модификации имеет структуру цинковой обманки (сфалерита). Решетка состоит из двух взаимопроникающих гранецентрированных кубических решеток, смещенных одна относительно другой по диагонали куба на 1/4 её длины. От структуры кристалла алмаза эта структура отличается тем, что атомы в подрешетках различны, в частности, в HgTe одна подрешетка содержит атомы ртути, а вторая — атомы теллура. Ртуть имеет два валентных электрона (подоболочка 6s), а теллур — шесть валентных электронов (оболочка 5s и частично заполненная подоболочка 5p), и сумма валентных электронов двух ближайших атомов всегда равна восьми. Таким образом, как и в алмазе, у каждого атома будет по четыре валентных электрона для образования четырёх валентных связей, направленных вдоль осей правильного тетраэдра. Для образования четырёх валентных связей нужны четыре неспаренных электрона. Вследствие принципа Паули один из двух s-электронов должен перейти на p-орбиту. Таким образом, возникает четырёхвалентное sp3 — состояние. Кроме того, необходимо учитывать, что в результате различия в зарядах атомных остатков Hg(2+) и Te(6+) химическая связь в HgTe имеет смешанный ионно-ковалентный характер. Другим важным свойством структуры цинковой обманки, связанным с наличием двух различных атомов, является отсутствие центра инверсии (симметрии).
Одной из особенностей теллурида ртути является то, что его состав может иметь значительные отклонения от стехиометрического состава (число атомов ртути и теллура в кристалле не равны). Поэтому свойства HgTe во многом определяются отклонениями от стехиометрического состава и наличием точечных дефектов, которые влияют на электрические свойства как атомы посторонних примесей. Поэтому данные о типе и проводимости HgTe противоречивы.
Физические и электрофизические
Представляет собой практически чёрные кубические кристаллы с постоянной решётки 0,646 нм при 300 К. Твердость по Моосу 2—2,5. Объёмный модуль упругости около 42 ГПа, прочность около 300 МПа. При обычных условиях устойчива кристаллическая структура типа сфалерита, при высоких давлениях кристалл испытывает фазовый переход и приобретает тригональную сингонию типа киновари (α-HgS).
По элетрическим свойствам представляет собой полуметалл, то есть при 0 К валентные зоны соприкасаются, но не перекрываются, поэтому, в отличие от полупроводников его проводимость не равна 0 при 0 К, но, как у полупроводников, растёт при росте температуры из-за перекрытия валентной зоны и зоны проводимости.
HgTe обладает уникальным квантовым свойством — топологической изоляции, обусловленный квантовой ямой в его тонких плёнках. При этом внутри кристалл является изолятором, а в тонком внешнем слое — проводником. Впервые об признаках такого поведения сообщили О. В. Панкратов с сотрудниками в 1986 г.[1] и эффект был открыт М. Кёнигом с сотрудниками в 2007 г.[2].
Химические
Связи атомов в HgTe почти ковалентны и слабы. Энтальпия образования из элементов около −32 кДж/моль. Легко разлагается даже слабыми кислотами, например, органическими или бромоводородной:
- HgTe + HBr = HgBr2 + H2Te,
Образующийся теллуроводород весьма ядовит, поэтому HgTe считается токсически опасным соединением.
Получение
Прямым синтезом из элементов — длительным нагреванием металлического теллура в парах ртути при повышенном давлении в запаянной кварцевой ампуле:
- Hg + Te = HgTe.
Эпитаксиальные монокристаллические плёнки HgTe могут быть получены методом газовой эпитаксии при разложении элементоорганических соединений теллура и ртути.
См. также
Примечания
- ↑ Успехи физических наук 1976 г. Том 119, вып. 6
- ↑ Konig, Markus; Steffen Wiedmann, Christoph Brune, Andreas Roth, Hartmut Buhmann, Laurens W. Molenkamp, Xiao-Liang Qi, Shou-Cheng Zhang (2007-11-02). «Quantum Spin Hall Insulator State in HgTe Quantum Wells». Science 318 (5851): 766–770. DOI:10.1126/science.1148047. PMID 17885096. Bibcode: 2007Sci...318..766K.
Литература
- Properties of Narrow-Gap Cadmium-Based Compounds Ed. P. Capper (INSPEC, IEE, London, UK, 1994) ISBN 0-85296-880-9.
- Tellurium and Tellurides, D. M. Chizhikov and V. P. Shchastlivyi, 1966, Nauka Publishing, Moscow.
- Datenblatt Quecksilbertellurid bei AlfaAesar, abgerufen am 11. Juli 2011.
Соединения ртутиАмидохлорид ртути (Hg(NH2)Cl) • Ацетат ртути(I) (Hg2(CH3COO)2) • Бромид ртути(I) (Hg2Br2) • Бромид ртути(II) (HgBr2) • Гидрид ртути(II) (HgH2) • Диметилртуть (Hg(CH3)2) • Диэтилртуть (Hg(C2H5)2) • Иодид ртути(I) (Hg2I2) • Иодид ртути(II) (HgI2) • Карбонат ртути(I) (Hg2(CO3)2) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Оксид ртути(I) (Hg2O) • Оксид ртути(II) (HgO) • Пероксид ртути (HgO2) • Селенид ртути (HgSe) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфид ртути(I) (Hg2S) • Сульфид ртути(II) (HgS) • Теллурид ртути (HgTe) • Тетраиодомеркурат(II) калия (K2[HgI4]) • Тиоцианат ртути(I) (Hg2(CNS)2) • Тиоцианат ртути(II) (Hg(CNS)2) • Фторид ртути(I) (Hg2F2) • Фторид ртути(II) (HgF2) • Фульминат ртути(II) (Hg(CNO)2) • Хлорид ртути(I) (Hg2Cl2) • Хлорид ртути(II) (HgCl2) • Хлорид этилртути (С2H5HgCl) • Цианид ртути(II) (Hg(CN)2) •
Соединения теллураГексафторид теллура (TeF6) • Диоксид теллура (TeO2) • Ортотеллурат натрия (Na6TeO6) Теллурат аммония ((NH4)2TeO4) Теллурид бериллия (BeTe) • Теллурид висмута(III) (Bi2Te3) • Теллурид кадмия (CdTe) • Теллурид натрия (Na2Te) • Теллурид олова (SnTe) • Теллурид ртути (HgTe) • Теллурид свинца (PbTe) • Теллурид цинка (ZnTe) • Теллурит калия (K2TeO3) • Теллурит натрия (Na2TeO3) • Теллуровая кислота (H2TeO4•2H2O) • Теллуроводород (H2Te) • Теллурофен C4H4Te • Тетрабромид теллура (TeBr4) • Тетрагидроортотеллурат калия K2H4TeO6 • Тетраиодид теллура (TeI4) • Тетрафторид теллура (TeF4) • Тетрахлорид теллура (TeCl4) • Триоксид теллура (TeO3) •
Категории:- Соединения ртути
- Соединения теллура
- Полупроводники
- Теллуриды
Wikimedia Foundation. 2010.
