- Индандион
-
Индан-1,3-дион 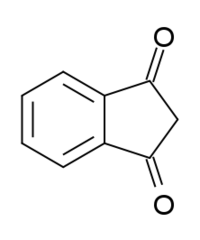
Общие Систематическое наименование Индан-1,3-дион
1,3-индандионТрадиционные названия Индандион
1,3-дикетогидринденЭмпирическая формула C9H6O2 Физические свойства Состояние (ст. усл.) бесцветное или желтоватое твёрдое Молярная масса 146.14 г/моль Плотность 1,37 [1] г/см³ Термические свойства Температура плавления 129—130 (или 132[2]) °C Энтальпия образования (ст. усл.) (для газа) -165,0 ± 2,6 кДж/моль Удельная теплота испарения (пересчитано из значения ниже) 0,497 Дж/кг Удельная теплота испарения 72,6 кДж/моль[3] Удельная теплота плавления (пересчитано) 0,118 Дж/кг Удельная теплота плавления 17,2 кДж/моль[3] Давление пара * 0,864 Pa (322,95 K)[3] - 23,543 Pa (357,71 K)[3]
Химические свойства pKa 7,4 Растворимость в воде небольшая г/100 мл Классификация Рег. номер CAS 606-23-5 Рег. номер PubChem 11815 SMILES C1C(=O)C2=CC=CC=C2C1=O Индан-1,3-дион — органическое вещество, представитель ненасыщенных транс-фиксированных β-дикетонов. В кристаллическом виде бесцветное или желтоватое и существует в форме именно дикетона. В водном же растворе частично енолизирован. Значительный вклад в развитие химии индандиона и его производных внёс профессор РТУ Г. Я. Ванаг — основатель рижской школы химиков-органиков.
Содержание
Особенности строения
Енольная форма характеризуется сопряжением и отрицательным частичным зарядом на 2-м атоме углерода и том атоме кислорода, который не связан с водородом (то есть, любой из двух). Анион же индандиона — это сопряжённая 6π-электронная система, отрицательный заряд делокализирован. Согласно приблизительным расчётам по методу МО Хюккеля (для такой системы транс-фиксированного дикетона вообще) наибольшая электронная плотность после обоих атомов кислорода находится опять-таки на 2-м атоме углерода. Это обуславливает многие его химические свойства.
Получение
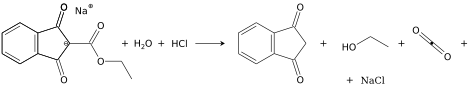
Индандион получают кислым гидролизом и одновременным декарбоксилированием натриевой соли 2-алкоксикарбонилиндан-1,3-диона (обычно этокси-) при повышенной температуре.
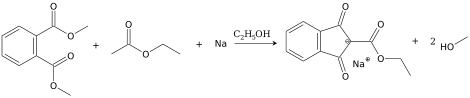
Саму же соль получают сложноэфирной конденсацией алкилацетата и диалкилфталата (обычно этилацетата и диэтил- или диметилфталата).
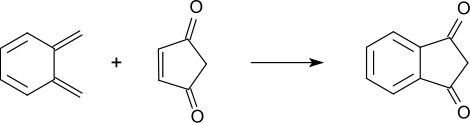
Кроме того, существует реакция типа реакции Дильса — Альдера, в которой из орто-ксилилена и циклопент-4-ен-1,3-диона.[4]
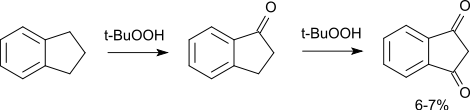
При окислении же индана такими реагентами, как пероксид водорода или трет-бутилгидропероксид, в качестве основного продукта получают индан-1-он, индандион получается лишь как примесь.[5]Химические свойства
Индан-1,3-дион является очень сильным C-нуклеофилом.
Специфические реакции
- Самоконденсация происходит весьма легко с образованием биндона — специфического реагента на первичные амины.
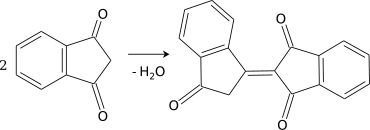
Общие для дикетонов свойства
- Енолизация — в воде pKE = 5,6, это соответствует двум процентам енола. Надо помнить, что в разных растворителях KE может быть разная ввиду различных эффектов сольватирования для OH- и CH-кислот. Как обычно, транс-фиксированные дикетоны с пятичленным циклом менее енолизированны, чем подобные соединения с шестичленным циклом — вероятно, ввиду невозможности образования стабилизующей водородной связи в еноле.
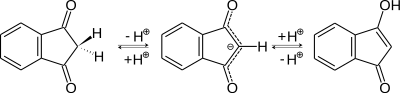
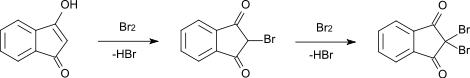
- Электрофильное присоединение — получаются продуты как C-, так и O-присоединения, но в основном реакция идёт, по-видимому, по 2-му атому углерода. Это, однако, зависит также от растворителя и концентрации веществ. Реакция происходит с енольной формой или анионом. Например, при бромировании можно получить в зависимости от стехиометрии 2-броминдан-1,3-дион или 2,2-диброминдан-1,3-дион.[6]
- Очень характерна реакция нитрования — проходит легко с образованием 2-нитроиндандиона — сильной кислоты. C-электрофилы обычно реагируют с анионом дикетона. Продукты реакции с альдегидами — обычно бис-продукты.
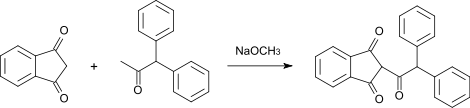
- В качестве примера ацилирования можно привести реакцию с 1,1-дифенилацетоном, которой можно получить родентицид 2-дифенилацетилиндан-1,3-дион (дифацинон или дифенадион).[7]
- В качестве других электрофильных реакций присоединения можно упомянуть галогенирование другими реагентами, сульфирование, азосочетание, нитрозирование.
- Нуклеофильное присоединение
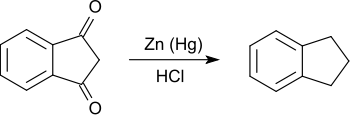
Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его.- Восстановление амальгамой цинка по Клемменсену приводит к индану, побочным же продуктом является инден.[8]
- Равно и каталитическое ионное гидрирование (триэтилсиланом и трифторуксусной кислотой) приводит к индану.[9]
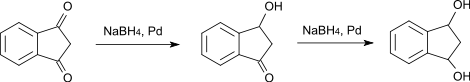
- Зато, восстанавливая селективным восстановителем боргидридом натрия (в присутствии палладиевого катализатора), получают 3-гидрокси-1-инданон; при дальнейшем восстановлении — соответственно, индан-1,3-диол.[10]
- Сходным образом и цинковая пыль в ледяной уксусной кислоте реагирует с образованием 3-гидрокси-1-инданона.[11]
- Гомолитические реакции — при взаимодействии индандиона с активными свободными радикалами, а также при окислении анионов образуются стабилизированные делокализацией радикалы, тут же вступающие в дальнейшие реакции, как, например, с алкадиенами, алкинами и друг с другом (димеризация). Особенно стабильны радикалы 2-арилпроизводных индандиона.
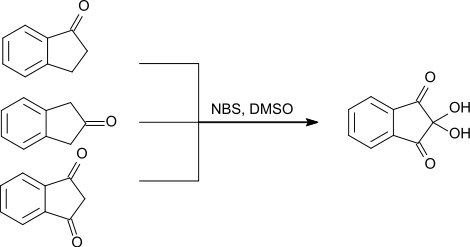
- Частным случаем является окисление индандиона в нингидрин с помощью NBS и диметилсульфоксида. Те же реагенты помогают получить нингидрин из 1-инданона и 2-инданона.[12]
Применение
Производные индандиона — биндон, 2-нитроиндандион, нингидрин — используют в аналитической химии. Есть производные, которые, возможно, будут использоваться в фотонике (ведутся исследования).[13] Некоторые производные являются препаратами, понижающими свёртываемость крови (антикоагулянты). В медицине, в частности, применяют арилпроизводные (фенилин — 2-фенилиндан-1,3-дион и омефин — 2-гидроксиметил-2-фенилиндан-1,3-дион). В качестве родентицида (крысиного яда) применяют ратиндан (2-дифенилацетилиндан-1,3-дион); нужно, однако, помнить, что этот способ травли крыс весьма жесток — крыса, ввиду своего образа жизни часто получающая небольшие царапины, истекает кровью и погибает от её потери.
Литература
- Нейланд О. Я. Органическая химия: Учеб. для хим. спец. вузов. Москва: Высшая школа, 1990.— с. 481—490.
- Valters, Raimonds. Organiskā ķīmija (speckurss). Lekciju konspekts. Rīga: RTU izdevniecība, 2009.— 114 lpp. (латыш.)
Примечания
- ↑ (англ.) 1,3-Indandione (TCI America)
- ↑ Sigma-Aldrich|ALDRICH|I2002|Время=20 октября 2010
- ↑ 1 2 3 4 (англ.) M. A. Matos, M. S. Miranda, M. J. Monte, L. M. Santos, V. M. Morais, J. S. Chickos, P. Umnahanant, J. F. Liebman: "Calorimetric and computational study of indanones" in J. Phys. Chem. A 2007, 111(43),S. 11153-9. Полный текст
- ↑ (англ.) D. B. Hansen and M. M. Joullie: "The development of novel ninhydrin analogues" in Chem. Soc. Rev., 2005, 34, S.408–417. DOI:10.1039/b315496n
- ↑ (англ.) J. Muzart: "Homogeneous CrVI-Catalyzed Benzylic, Allylic and Propargylic Oxidations by tert-Butyl Hydroperoxide" in Mini-Reviews in Organic Chemistry 2009, (6), S. 9-20. [www.bentham.org/mroc/sample/mroc6-1/002AK.pdf Volltext]
- ↑ (англ.) D. Nematollahi, N. Akaberi: "Electrochemical Study of Bromide in the Presence of 1,3-Indandione. Application to the Electrochemical Synthesis of Bromo Derivatives of 1,3-Indandione" in Molecules 2001, 6, S. 639-646.Полный текст
- ↑ (англ.) Thomas A. Unger: "Pesticide Synthesis Handbook", Verlag William Andrew, 1996. ISBN 978-0-8155-1401-5. S. 900. (Google Книги|BookID=blYN-_pY9_IC|стр. 900)
- ↑ (англ.) S. A. Galton, M. Kalafer, F. M. Beringer: "Rearrangements in the Clemmensen reduction of 1-indanones and, 1,3-indandiones" in J. Org. Chem., 1970, 35(1), S.1–6. DOI:10.1021/jo00826a001
- ↑ (англ.) O. K. Popova, Z. N. Parnes, M. I. Katinkin, S. M. Markosyan, N. I. Kopteva, L. P. Zalukaev, D. N. Kursanov: "Ionic hydrogenation of 1,3-indanedione derivatives" in Russian Chemical Bulletin, 1981, 30(9), S. 1709-1711. DOI:10.1007/BF00949478
- ↑ (англ.) J. F. Neumer: "2,3-Disubstituted 1-Indanones", United States Patent 3992450. Полный текст
- ↑ (англ.) S. M. Resnick, D. S. Torock, K. Lee, J. M. Brand, D. T. Gibson: "Regiospecific and Stereoselective Hydroxylation of 1-Indanone and 2-Indanone by Naphthalene Dioxygenase and Toluene Dioxygenase" in Applied and Environmental Microbiology 1994, 60(9), S. 3323-3328.Полный текст
- ↑ (англ.) J. L. Hallman: "Synthesis of Naphtho(f)ninhydrin and Synthesis of Polymer-supported Crown Ethers". Dissertation, 1991.Полный текст
- ↑ Nonlinear optical properties of some indandione-1,3 pyridinium betaine derivatives | Publications: SPIE

В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 10 июня 2011.У этой статьи нет иллюстраций. Вы можете помочь проекту, добавив их (с соблюдением правил использования изображений).
Для поиска иллюстраций можно:- попробовать воспользоваться инструментом FIST: нажмите эту ссылку, чтобы начать поиск;
- попытаться найти изображение на Викискладе;
- просмотреть иноязычные варианты статьи (если они есть);
- см. также Википедия:Источники изображений.
Эту статью следует викифицировать. Пожалуйста, оформите её согласно правилам оформления статей.Категории:- Кетоны
- Циклические соединения
Wikimedia Foundation. 2010.