- СВЯЗЬ ВЕКТОРНАЯ
- СВЯЗЬ ВЕКТОРНАЯ
-
- наглядная модель векторного сложения орбитальных li и спиновых si моментов в полныймомент J квантовой системы (атома, атомного ядра, молекулы), характеризующаявзаимодействие электронов в атомах и молекулах и нуклонов в атомных ядрах.
В нулевом приближении энергия атома определяется сферически симметричнойчастью электростатич. взаимодействия V эс электронов с ядроми между собой. При этом каждый уровень энергии системы, имеющий конфигурацию
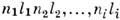 , оказывается 2i(2l1+l)(2l2+l)...(2li+1)- кратно вырожденным в соответствии с числом возможных проекций орбитального
, оказывается 2i(2l1+l)(2l2+l)...(2li+1)- кратно вырожденным в соответствии с числом возможных проекций орбитального 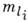 и спинового
и спинового 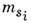 моментов.
моментов.Нецентральная часть взаимодействия V эс и спин-орбитальноевзаимодействие Vco приводят к расщеплению уровня энергии атомана подуровни, относительное расположение к-рых во мн. случаях можно описатьс помощью определённой схемы сложения моментов li и si т. е. типом С. в.
Для двух неэквивалентных электронов с моментами l1,si и l2, s2 возможны след. <типы С. в.:
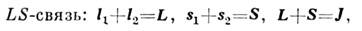
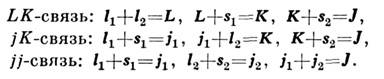
При любой схеме С. в. векторное сложение всех моментов даёт один и тотже полный момент J системы. Два промежуточных квантовых числа используютсядля обозначения типа связи и классификации подуровней энергии.
Для электронной оболочки из эквивалентных электронов (т. е. электронов, <состояние к-рых описывается одинаковым набором квантовых чисел) вследствие Паули принципа возможны лишь LS- или jj-типы С. в., в к-рыхвсе электроны участвуют симметричным образом, что следует из принципа неразличимостиэлектронов.
Каждый тип С. в. характеризует относит. величины разл. типов взаимодействияэлектронов. В случае LS-связи (наз. ещё нормальной или рассел-саундеровскойсвязью) электростатич. взаимодействие намного больше спин-орбитального:
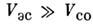 . Нормальная связь характерна для не очень тяжелых нейтральных и слабоионизов. <атомов, находящихся в не слишком высоковозбуждённых состояниях. В противоположномслучае
. Нормальная связь характерна для не очень тяжелых нейтральных и слабоионизов. <атомов, находящихся в не слишком высоковозбуждённых состояниях. В противоположномслучае 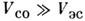 реализуетсяjj-связь. Она используется для описания уровней энергии тяжёлых атомови многозарядных ионов. Переход от LS- к jj-типу С. в. с ростомзаряда ядра Z объясняется разной зависимостью взаимодействий от Z: электростатич. взаимодействие
реализуетсяjj-связь. Она используется для описания уровней энергии тяжёлых атомови многозарядных ионов. Переход от LS- к jj-типу С. в. с ростомзаряда ядра Z объясняется разной зависимостью взаимодействий от Z: электростатич. взаимодействие 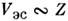 ,а спин-орбитальное
,а спин-орбитальное 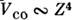 .Поэтому в изоэлектронном ряду с ростом Z происходит непрерывныйпереход от LS- к jj-связи. Относит. роль взаимодействий У эс и Vco может быть различной для разных уровней энергии одногои того же атома или иона, поэтому при классификации энергетич. спектраодной и той же конфигурации часто используются разл. типы С. в.
.Поэтому в изоэлектронном ряду с ростом Z происходит непрерывныйпереход от LS- к jj-связи. Относит. роль взаимодействий У эс и Vco может быть различной для разных уровней энергии одногои того же атома или иона, поэтому при классификации энергетич. спектраодной и той же конфигурации часто используются разл. типы С. в.Нормальная и jj-связи наз. однородными типами связи, a LK- и jK-связи- неоднородными. В ряде случаев ни один из типов «чистой» связи неявляется точным и приходится использовать промежуточные типы связи. Общеечисло уровней с данным J одинаково для всех типов связи. (Классификациюуровней энергии см. в СТ. Мультиплетность.)
Лит.: Никитин А. А., Рудзикас З. Б., Основы теории спектров атомови ионов, М., 1983. В. П. Шевелъко.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
