- ТОНКАЯ СТРУКТУРА
- ТОНКАЯ СТРУКТУРА
-
(мультиплетное расщепление), расщепление уровней энергии и спектр. линий атомов, молекул и кристаллов, обусловленное спин-орбитальным взаимодействием. Число подуровней, на к-рое расщепляется уровень энергии, зависит от числа возможных ориентации спина (от мультиплетности c) и не превышает c; в частности, для атомов щелочных металлов спин внеш. эл-на может иметь две ориентации (c=2) и их уровни расщепляются на два подуровня (дублетное расщепление), а спектр. линии — на две близко расположенные линии (дублеты).Для лёгких атомов величина «тонкого» расщепления уровней энергии не превышает 10-5 эВ, а соответствующая величина для спектр. линий (в волн. числах) — неск. см-1. Расщепление уровней энергии сильно возрастает с увеличением заряда ядра, для уровней энергии тяжёлых атомов оно может достигать десятых долей эВ и уже перестаёт быть «тонким».
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ТОНКАЯ СТРУКТУРА
-
(мультиплетное расщепление) уровней энергии - расщепление уровней энергии (термов) атома, молекулы или кристалла, обусловленное гл. обр. спин-орбитальным взаимодействием. Тонкое расщепление уровней - причина возникновения T. с. спектральных линий. Мультиплетное расщепление электронных уровней энергии молекул связано с т. н. взаимодействием спин - ось.
Спин-орбитальное взаимодействие играет осн. роль в атомах с одним электроном сверх заполненных оболочек, а также атомов, расположенных в середине и в конце периодич. системы. Число подуровней, на к-рое расщепляется уровень энергии с полным орбитальным моментом L и полным спином S при S<=L, равно мультиплетности уровня энергии 2S+1, а при S>L оно равно 2L+1.
Каждый подуровень (компонента T. с.) характеризуется квантовым числом J полного момента импульса электрона: J= L + S. Разности энергий между соседними компонентами T. с. уровня энергии с данными L и S в большинстве случаев, когда понятие T. с. имеет смысл, удовлетворяют правилу интервалов Ланде:
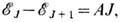 где А- постоянная спин-орбитального взаимодействия, зависящая только от L и S. Для высоко возбуждённых уровней
где А- постоянная спин-орбитального взаимодействия, зависящая только от L и S. Для высоко возбуждённых уровней 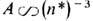 , где
, где 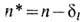 -эффективное главное квантовое число, dl - квантовый дефект. В многоэлектронных атомах правило интервалов Ланде иногда нарушается вследствие взаимодействия (наложения) конфигураций, а также магн. взаимодействий между спинами электронов и взаимодействий спина одного электрона с орбитальными моментами др. электронов (взаимодействие спин - чужая орбита). Последние два типа взаимодействий играют важную роль в гелиеподобных и нек-рых др. лёгких атомах и ионах.
-эффективное главное квантовое число, dl - квантовый дефект. В многоэлектронных атомах правило интервалов Ланде иногда нарушается вследствие взаимодействия (наложения) конфигураций, а также магн. взаимодействий между спинами электронов и взаимодействий спина одного электрона с орбитальными моментами др. электронов (взаимодействие спин - чужая орбита). Последние два типа взаимодействий играют важную роль в гелиеподобных и нек-рых др. лёгких атомах и ионах.
В спектрах водородоподобных атомов (S=1/2) сдвиг уровня энергии (с учётом зависимости массы от скорости) равен:
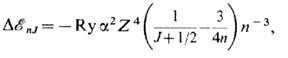
где
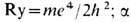 - тонкой структуры постоянная; Z- заряд ядра; n- главное квантовое число.
- тонкой структуры постоянная; Z- заряд ядра; n- главное квантовое число.
Величина тонкого расщепления ниж. уровней у самых лёгких атомов (H, Не, Li, Be) порядка 0,1 - 1 см -1 и быстро растёт с увеличением атомного номера (заряда ядра). Напр., расщепление осн. уровня энергии атома иода (Z =53) составляет 7603 см -1.
О T. с. уровней энергии атома имеет смысл говорить лишь в том случае, когда достаточно хорошо выполняется приближение LS- или jK -связи (см. Связь векторная )и тонкое расщепление мало по сравнению с расстоянием между уровнями энергии.
Иногда термином "Т. с." наз. пики или провалы в пределах контура спектральной линии, возникающие по к.-л. причине.
Лит. см. при статьях Атом, Атомные спектры, Молекула.
E. А. Юков.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
