- Хлорид натрия
-
Хлорид натрия 
Общие Традиционные названия обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] Химическая формула NaCl Физические свойства Молярная масса 58,44277 г/моль Плотность 2,165 г/см³ Термические свойства Температура плавления 800,8 °C Температура кипения 1465 °C Молярная теплоёмкость (ст. усл.) 50,8 Дж/(моль·К) Удельная теплота испарения 170,85 кДж/моль Дж/кг Удельная теплота плавления 28,68 кДж/моль Дж/кг Химические свойства pKa 6,7–7,3 Растворимость в воде 35,6 (0 °C)
35,9 (25 °C)
39,1 (100 °C) г/100 млРастворимость в метаноле 14,9 г/100 мл Растворимость в аммиаке 21,5 г/100 мл Оптические свойства Показатель преломления 1,5442 (589 нм) Структура Координационная геометрия Октаэдральная (Na +)
Октаэдральная (Cl -)Кристаллическая структура гранецентрированная кубическая, cF8 Классификация Рег. номер CAS [7647-14-5] Рег. номер PubChem 5234 Рег. номер EINECS 231-598-3 SMILES [Na+].[Cl-] RTECS VZ4725000 Безопасность ЛД50 3000–8000 мг/кг NFPA 704 Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Содержание
- 1 Нахождение в природе и производство
- 2 Применение
- 3 Физические и физико-химические свойства
- 4 Лабораторное получение и химические свойства
- 5 Структура
- 6 См. также
- 7 Примечания
- 8 Ссылки
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10 15 тонн NaCl, то есть из каждой тысячи тонн морской воды можно получить в среднем 1,3 тонны хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, состоят из NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на мелководье соленая вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
Соединение Масс. доля, % NaCl 77,8 MgCl2 10,9 MgSO4 4,7 KCl 2,5 K2SO4 2,5 CaCO3 0,3 Ca(HCO3)2 0,3 другие соли 0,2 При испарении морской воды при температуре 20 — 35 ° C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы[6]:

…на мори от чрена и от салгы по пузу… 
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
Применение
В пищевой промышленности и кулинарии
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
- CaR2 + 2NаСl = 2NаR + CaСl2.
- МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl + 3 H2O → NaClO3 + 3 H2↑
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H +, образованных в результате электролитической диссоциации воды:
- H2O ⇆ H+ + OH−
- 2 H+ + 2 e− → H2↑
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl → Na+ + Cl−
- 2 Cl− − 2 e− → Cl2↑
- суммарная реакция:
- 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- 2 Na+ + 2 e− → 2 Na
- на аноде выделяется хлор (как побочный продукт):
- 2 Cl− − 2 e− → Cl2
- суммарная реакция:
- 2 Na+ + 2 Cl− → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (800 ° C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления 580 ° C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (371 ° C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl + H2SO4 → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идет почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca 2 +, Mg 2 + и SO2−4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H 2 O можно выделить при температуре ниже +0,15 ° C[21].
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
Термодинамические характеристики ΔfH0g −181,42 кДж/моль ΔfH0l −385,92 кДж/моль ΔfH0s −411,12 кДж/моль ΔfH0aq −407 кДж/моль S0g, 1 bar 229,79 Дж/(моль·K) S0l, 1 bar 95,06 Дж/(моль·K) S0s 72,11 Дж/(моль·K) Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
Концентрация, % Концентрация, г/л Плотность, г/мл 1 10,05 1,005 2 20,25 1,012 4 41,07 1,027 6 62,47 1,041 8 84,47 1,056 10 107,1 1,071 12 130,2 1,086 14 154,1 1,101 16 178,5 1,116 18 203,7 1,132 20 229,5 1,148 22 256 1,164 24 283,2 1,18 26 311,2 1,197 Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- Na(тв) + 1/2Cl2(г) → NaCl(тв) + 410 кДж
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaОН + НCl → NaCl + Н2О
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−, его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
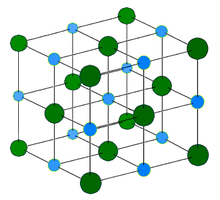
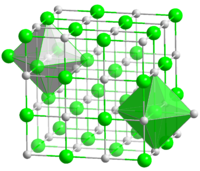
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, a = 0,563874 нм, d = 2,17 г/см³. Каждый из ионов Cl− окружен шестью ионами Na+ в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура с ионов Cl−, называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
См. также
- Поваренная соль — специя и пищевая добавка
- Галит — минерал
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии (англ. National Institute of Standards and Technology) (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого . — Донецк: «Донбасс», 2004. — ISBN 966-7804-14-3
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х-ХХ веков. Законодательство Древней Руси. т. 1. М, 1984. С. 224—225. (рус.)
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 М. Л. Глинка Общая химия (Учебник), изд. 2-е изд., Перераб. и доп .. — С. 608, Киев: «Высшая школа», 1982.
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 191
Ссылки

Хлорид натрия на Викискладе? Шаблон:АТХ код A07
Плазмозамещающие и перфузионные растворы — АТХ код:Препараты крови Плазмозамещающие препараты и белковые фракции плазмыАльбумин () • Фторкарбоновые кровезаменители () • Декстран () • Препараты желатина () • Гидроксиэтилкрахмал () • Гемоглобин глутамер (бычий) () Растворы для в/в введения Растворы для парентерального питанияАминокислоты () • Жировые эмульсии () • Углеводы () • Гидролизаты белков () • Комбинированные препараты для парентерального питания () Растворы, влияющие на водно-электролитный балансЭлектролиты () • Электролиты в сочетании с углеводами () • Трометамол () ОсмодиуретикиМаннитол () Ирригационные растворы Солевые растворыНатрия хлорид () • Натрия гидрокарбонат () Прочие ирригационные растворыДекстроза () Растворы для перитонеального диализа Изотонические растворыИкодекстрин () Гипертонические растворыНатрия хлорид () Добавки к растворам для в/в введения Электролитные растворыКалия хлорид () • Магния сульфат () • Кальция хлорид () • Кардиоплегические растворы () • Электролиты в комбинации с другими препаратами () АминокислотыАланилглутамин () Гемодиализаты и гемофильтраты Гемодиализаты (концентраты)Солкосерил () Категории:- Соединения натрия
- Хлориды
Wikimedia Foundation. 2010.