- Двуокись титана
-
 Порошок оксида титана
Порошок оксида титанаОксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 — амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды).[1]
- ICSC 0338
- CAS [13463-67-7]
- RTECS XR2775000
- EC —
Содержание
Строение
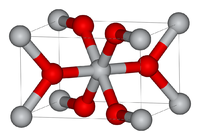 Диоксид титана в рутильной форме
Диоксид титана в рутильной форме
Серым цветом обозначены атомы титана, красным — кислородаОксид титана существует в виде нескольких модификаций. В природе встречаются кристаллы с тетрагональной сингонией (анатаз, рутил) и ромбической сингонией (брукит). Искусственно получены ещё две модификации высокого давления — ромбическая IV и гексагональная V.
Характеристики кристаллической решётки[2] Модификация/Параметр Рутил Анатаз Брукит Ромбическая IV Гексагональная V Параметры элементарной решётки, нм a 0,45929 0,3785 0,51447 0,4531 0,922 b — — 0,9184 0,5498 — c 0,29591 0,9486 0,5145 0,4900 0,5685 Число формульных единиц в ячейке 2 4 8 Пространственная группа P4/mnm I4/amd Pbca Pbcn При нагревании и анатаз, и брукит необратимо превращаются в рутил (температуры перехода соответственно 400—1000°C и около 750 °C). Основой структур этих модификаций являются октаэдры TiO6, то есть каждый ион Ti4+ окружён шестью ионами O2-, а каждый ион O2- окружён тремя ионами Ti4+. Октаэдры расположены таким образом, что каждый ион кислорода принадлежит трём октаэдрам. В анатазе на один октаэдр приходятся 4 общих ребра, в рутиле — 2.
Нахождение в природе
В чистом виде в природе встречается в виде минералов рутила, анатаза и брукита (по строению первые два имеют тетрагональную, а последний - ромбическую сингонию), причём основную часть составляет рутил.
Третье в мире по запасам рутила месторождение находится в Рассказовском районе Тамбовской области. Крупные месторождения находятся также в Чили (Cerro Bianco), канадской провинции Квебек, Сьерра-Леоне.
Свойства
Физические, термодинамическе свойства
Чистый диоксид титана — бесцветные кристаллы (желтеет при нагревании). Для технических целей применяется в раздробленном состоянии, представляя собой белый порошок. Не растворяется в воде и разбавленных минеральных кислотах (за исключением плавиковой).
- Температура плавления для рутила — 1870 °C (по другим данным — 1850 °C, 1855 °C)
- Температура кипения для рутила — 2500 °C.
- Плотность при 20 °C:
- Температура разложения для рутила 2900 °C[3]
Температура плавления, кипения и разложения для других модификаций не указана, т.к. они переходят в рутильную форму при нагревании (см. выше).
Средняя изобарная теплоёмкость Cp (в Дж/(моль·К))[4] Модификация Интервал температуры, K 298—500 298—600 298—700 298—800 298—900 298—1000 рутил 60,71 62,39 63,76 64,92 65,95 66,89 анатаз 63,21 65,18 66,59 67,64 68,47 69,12 Термодинамические свойства[5] Модификация ΔH°f, 298, кДж/моль[6] S°298, Дж/моль/K[7] ΔG°f, 298, кДж/моль[8] C°p, 298, Дж/моль/K[9] ΔHпл., кДж/моль[10] рутил -944,75 (-943,9[3]) 50,33 -889,49 (-888,6[3]) 55,04 (55,02[3]) 67 анатаз -933,03 (938,6[3]) 49,92 -877,65 (-888,3 [3]) 55,21 (55,48 [3]) 58 Вследствие более плотной упаковки ионов в кристалле рутила увеличивается их взаимное притяжение, снижается фотохимическая активность, увеличиваются твёрдость (абразивность), показатель преломления (2,55 — у анатаза и 2,7 — у рутила), диэлектрическая постоянная.
Химические свойства
Диоксид титана амфотерен, то есть проявляет как осно́вные, так и кислотные свойства (хотя реагирует главным образом с концентрированными кислотами).
Медленно растворяется в концентированной серной кислоте, образуя соответствующие соли четырёхвалентного титана:
TiO2 + 2H2SO4 → Ti(SO4)2 + 2H2O
В концентрированных растворах щелочей или при сплавлении с ними образуются титанаты — соли титановой кислоты (амфотерного гидроксида титана TiO(OH)2)
TiO2 + 2NaOH → Na2TiO3 + H2O
То же происходит и в концентрированных растворах карбонатов или гидрокарбонатов:
TiO2 + K2CO3 → K2TiO3 + CO2↑ TiO2 + 2KHCO3 → K2TiO3 + 2CO2↑ + H2O
C перекисью водорода даёт ортотитановую кислоту:
TiO2 + 2H2O2 → H4TiO4 + О2↑
При нагревании с аммиаком даёт нитрид титана:
2TiO2 + 4NH3 →(t) 4TiN + 6H2O + O2↑
При сплавлении с оксидами, гидроксидами и карбонатами образуются титанаты и двойные оксиды:
TiO2 + BaO → BaO·TiO2
TiO2 + BaCO3 → BaO·TiO2 + CO2↑
TiO2 + Ba(OH)2 → BaO·TiO2 + H2O
При нагревании восстанавливается углеродом и активными металлами (Mg, Ca, Na) до низших оксидов.
При нагревании с хлором в присутствии восстановителей (углерода) образует тетрахлорид титана.
Нагревание до 2200 °C приводит сначала к отщеплению кислорода с образованием синего Ti3O5 (то есть TiO2·Ti2O3), а затем и тёмно-фиолетового Ti2O3.
Гидратированный диоксид TiO2·nH2O [гидроксид титана(IV), оксо-гидрат титана, оксогидроксид титана] в зависимости от условий получения может содержать переменные количества связанных с Ti групп ОН, структурную воду, кислотные остатки и адсорбированные катионы. Полученный на холоде свежеосажденный TiO2·nH2O хорошо растворяется в разбавленных минеральных и сильных органических кислотах, но почти не растворяется в растворах щелочей. Легко пептизируется с образованием устойчивых коллоидных растворов. При высушивании на воздухе образует объёмистый белый порошок плотностью 2,6 г/см³, приближающийся по составу к формуле TiO2·2H2O (ортотитановая кислота). При нагревании и длительной сушке в вакууме постепенно обезвоживается, приближаясь по составу к формуле TiO2·H2O (метатитановая кислота). Осадки такого состава получаются при осаждении из горячих растворов, при взаимодействии металлического титана с HNO3 и т. п. Их плотность ~ 3,2 г/см³ и выше. Они практически не растворяются в разбавленных кислотах, не способны пептизироваться.
При старении осадки TiO2·nH2O постепенно превращается в безводный диоксид, удерживающий в связанном состоянии адсорбированные катионы и анионы. Старение ускоряется кипячением суспензии с водой. Структура образующегося при старении TiO2 определяется условиями осаждения. При осаждении аммиаком из солянокислых растворов при рН < 2 получаются образцы со структурой рутила, при рН 2—5 — со структурой анатаза, из щелочной среды — рентгеноаморфные. Из сульфатных растворов продукты со структурой рутила не образуются.
Токсические свойства, физиологическое действие, опасные свойства
TLV(предельная пороговая концентрация, США): как TWA (среднесменная концентрация, США) 10 мг/м³ A4 (ACGIH 2001).
ПДК в воздухе рабочей зоны - 10 мг/м³ (1998)
ООН — 2546
Добыча и производство
Полная статья получение оксида титана(IV)
Мировое производство диоксида титана на конец 2004 года достигло приблизительно 5 миллионов тонн. [11]
Основными производители и экспортёры диоксида титана:
- KEMIRA PIGMENTS OY (Финляндия)
- ЗАО «Крымский Титан» (АР Крым)
- KRONOS TITAN GmbH & Co. OHG (Германия)
- Sachtleben (Германия)
- Kerr-McGee (США)
В последние годы чрезвычайно быстро растет производство диоксида титана в Китае.
В России пигментный диоксид титана не производят, но производят технические марки, используемые в металлургии. На территории СНГ диоксид титана производится на Украине предприятиями «Сумыхимпром», город Сумы, «Крымский титан», г. Армянск) и КП "Титано-магниевый комбинат" (г. Запорожье). Сумский государственный институт минеральных удобрений и пигментов (МИНДИП) в своих научно-исследовательских работах особое место уделяет технология получения оксида титана (IV) сульфатным способом: исследование, разработка новых марок, модернизация технологии и аппаратурного оформления процесса.
Как указано выше, диоксид титана встречается в виде минералов, однако этого источника недостаточно, поэтому значительная его часть производится. Существуют два основных промышленных метода получения TiO2: из ильменитового (FeTiO3) концентрата и из тетрахлорида титана.
Производство диоксида титана из ильменитового концентрата
Технология производства состоит из трёх этапов:
- получение растворов сульфата титана (путём обработки ильменитовых концентратов серной кислотой). В результате получают смесь сульфата титана и сульфатов железа (II) и (III), последний восстанавливают металлическим железом до степени окисления железа +2. После восстановления на барабанных вакуум-фильтрах отделяют растворов сульфтов от шлама. Сульфат железа(II) отделяют в вакуум-кристаллизаторе.
- гидролиз раствора сульфатных солей титана. Гидролиз проводят методом введения зародышей (их готовят осаждая Ti(OH)4 из растворов сульфата титана гидроксидом натрия). На этапе гидролиза образующиеся частицы гидролизата (гидратов диоксида титана) обладают высокой адсорбционной способностью, особенно по отношению к солям Fe3+, именно по этой причине на предыдущей стадии трёхвалентное железо восстанавливается до двухвалентного. Варьируя условия проведения гидролиза (концентрацию, длительность стадий, количество зародышей, кислотность и т. п.) можно добиться выхода частиц гидролизата с заданными свойствами, в зависимости от предполагаемого применения.
- термообработка гидратов диоксида титана. На этом этапе, варьируя температуру сушки и используя добавки (такие, как оксид цинка, хлорид титана и используя другие методы можно провести рутилизацию (то есть перестройку оксида титана в рутильную модификацию). Для термообработки используют вращающиеся барабанные печи длиной 40—60 м. При термообработке испаряется вода (гидроксид титана и гидраты оксида титана переходят в форму диоксида титана), а также диоксид серы.
Производство диоксида титана из тетрахлорида титана
Существуют три основных метода получения диоксида титана из его тетрахлорида:
- гидролиз водных растворов тетрахлорида титана (с последующей термообработкой осадка)
- парофазный гидролиз тетрахлорида титана (основан на взаимодействии паров тетрахлорида титана с парами воды). Процесс обычно ведётся при температуре 900—1000°C
- термообработка тетрахлорида (сжигание в токе кислорода)
Применение
Основные применения диоксида титана:
- производителей лакокрасочных материалов, в частности, титановых белил — 57 % от всего потребления[11] (диоксид титана рутильной модификации обладает более высокими пигментными свойствами — светостойкостью, разбеливающей способностью и др.)
- производство пластмасс — 21 %[11]
- производство ламинированной бумаги — 14 %[11]
Мировые мощности по производству пигментов на основе диоксида титана (тыс. тонн/год)[12] 2001 г. 2002 г. 2003 г. 2004 г. Америка 1730 1730 1730 1680 Запад. Европа 1440 1470 1480 1480 Япония 340 340 320 320 Австралия 180 200 200 200 Прочие страны 690 740 1200 1400 Всего 4380 4480 4930 5080 Другие применения — в производстве резиновых изделий, стекольном производстве (термостойкое и оптическое стекло), как огнеупор (обмазка сварочных электродов и покрытий литейных форм), в косметических средствах (мыло и т.д.), в пищевой промышленности (пищевая добавка E171).
Цены и рынок
Цены на диоксид титана отличаются в зависимости от степени чистоты и марки. Так, особо чистый (99,999 %) диоксид титана в рутильной и анатазной форме стоил в сентябре 2006 года 0,5—1 доллара за грамм (в зависимости от размера покупки), а технический диоксид титана — 2,2—4,8 доллара за килограмм в зависимости от марки и объёма покупки[13].
Нормативы
- Двуокись титана пигментная. Технические условия ГОСТ 9808-84
В настоящее время диоксид титана по ГОСТ 9808-84 не выпускается.
- Диоксид титана пигментный. ТУ У 24.1-05762329-001-2003
По данным техническим условиям работает ГАК "Титан" (г. Армянск).
- Титана диоксид пигментный. ТУ У 24.1-05766356-054:2005
По данным техническим условиям работает ОАО "Сумыхимпром" (г. Сумы).
Использованная литература
- Б. В. Некрасов. Основы общей химии. Т. I изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. С. 644, 648
- Т. Г. Ахметов, Р. Т. Порфирьева, Л. Г. Гайсин и др. Химическая технология неорганических веществ: в 2 кн. Кн. 1 Под ред. Т. Г. Ахметова.—М.:Высшая школа, 2002 ISBN 5-06-004244-8 С. 369—402
- Химия: Справ. изд./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. 2-е изд., стереотип. — М.:Химия, 2000. С. 411
- Химическая энциклопедия (электронная версия) С. 593, 594
Ссылки
- Мировой рынок пигментного диоксида титана Состояние, тенденции, прогнозы
- TiO2 — Titanium Dioxide | Двуокись титана (диоксид титана) | Свойства, область применения, производители диоксида титана
- Международная карта химической безопасности для диоксида титана
- Titanium dioxide Информация из Химической базы данных Акронского университета
- Сумский государственный институт минеральных удобрений и пигментов (МИНДИП) (г.Сумы, Украина)
Примечания
- ↑ http://www.snab.ru/lkm2/01/03.pdf
- ↑ 1 2 3 4 Химическая энциклопедия
- ↑ 1 2 3 4 5 6 7 8 Рабинович. В. А., Хавин З. Я. Краткий химический справочник Л.:Химия, 1977 с. 105
- ↑ Краткий справочник физико-химических величин. Изд. 8-е, перераб./Под ред. А. А. Равделя и А. М. Пономаревой. — Л.:Химия, 1983. С.60
- ↑ Кроме изменения стандартной энтальпии плавления там же с. 82
- ↑ изменение стандартной энтальпии (теплоты образования) при образовании из простых веществ, термодинамически устойчивых при 101,325 кПа (1 атм) и температуре 298 K
- ↑ стандартная энтропия при температуре 298 K
- ↑ изменение стандартной энергии Гиббса (теплоты образования) при образовании из простых веществ, термодинамически устойчивых при 101,325 кПа (1 атм) и температуре 298 K
- ↑ стандартная изобарная теплоёмкость при температуре 298 K
- ↑ Изменение энтальпии плавления. Данные по Химической энциклопедии с. 593
- ↑ 1 2 3 4 http://www.titanium-chemical.com
- ↑ http://www.titanmet.ru/Pages/News.aspx?action=view&nid=4eeff716-272d-433f-a74d-a6e046c66a86&lang=ru
- ↑ http://www.pure-tio2.com/buy.htm
Wikimedia Foundation. 2010.
