- Лиганд
-
Лига́нд (от лат. ligare — связывать) — атом, ион или молекула, связанные с неким центром (акцептором). Понятие применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами (рецепторами, иммуноглобулинами), а также в химии комплексных соединений, обозначая там присоединенные к одному или нескольким центральным (комплексообразующим) атомам металла частицы.
Содержание
В неорганической химии
Чаще всего такое связывание происходит с образованием так называемой «координационной» донорно-акцепторной связи, где лиганды выступают в роли основания Льюиса, то есть являются донорами электронной пары. При присоединении лигандов к центральному атому химические свойства комплексообразователя и самих лигандов часто претерпевают значительные изменения.
Номенклатура лигандов
- первым в названии соединения в именительном падеже называется анион, а затем в родительном — катион
- в названии комплексного иона сначала перечисляются лиганды в алфавитном порядке, а затем центральный атом
- центральный атом в нейтральных катионных комплексах называются русским названием, а в анионах корнем латинского названия с суффиксом «ат». После названия центрального атома указывается степень окисления.
- число лигандов, присоединенных к центральному атому, указывается приставками «моно», «ди», «три», «тетра», «пента», и т. д.
Характеристики лигандов
Электронное строение
Собственно, важнейшая характеристика лиганда, позволяющая оценить и спрогнозировать его способности к комплексообразованию и саморазрушению D-орбитали — разрушения соединения в целом. В первом приближении включает в себя количество электронных пар, которые лиганд способен выделить на создание координационных связей и электроотрицательность донирующего атома или функциональной группы.
Дентатность
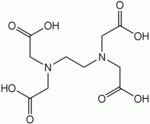
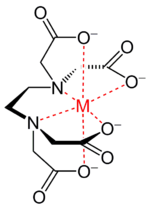
Число занимаемых лигандом координационных мест центрального атома (или атомов), называется дентатностью (от лат. dens, dent- — зуб). Лиганды, занимающие одно координационное место, называются монодентатными (например, NH3), два — бидентатными (оксалат-анион [O-C(=O)-C(=O)-O]2−). Лиганды, способные занять большее количество мест, обычно обозначают как полидентатные. Например, этилендиаминтетрауксусная кислота (EDTA), способная занять шесть координационных мест.
Кроме дентатности, существует характеристика, отражающая количество атомов лиганда, связанных с одним координационным местом центрального атома. В английской литературе обозначается словом hapticity и имеет номенклатурное обозначение η с соответствующим надстрочным индексом. Хотя устоявшегося термина в русском языке она, по-видимому, не имеет, в некоторых источниках можно встретить кальку «гаптность»[1]. Как пример, можно привести циклопентадиенильный лиганд в металлоцентровых комплексах, занимающий одно координационное место (то есть, являющийся монодентатным) и связанный через все пять атомов углерода: η5-[C5H5]−.
Способы координации
Лиганды с дентатностью больше двух способны образовывать хелатные комплексы (греч. χηλή — коготь) — комплексы, где центральный атом включен в один или более циклов с молекулой лиганда. Такие лиганды называются хелатирующими. Как пример можно привести комплексы тетрааниона той же EDTA, обратив внимание, что несколько из четырёх связей M—O в нём могут формально являться ионными.
При образовани хелатных комплексов часто наблюдается хелатный эффект — большая их стабильность по сравнению с аналогичными комплексами не-хелатирующих лигандов. Он достигается за счет большего экранирования центрального атома от замещающих воздействий и энтропийного эффекта. Например, константа диссоциации аммиачного комплекса кадмия [Cd(NH3)4]2+ почти в 1500 раз меньше, чем комплекса с этилендиамином [Cd(en)2]2+. Причина этого заключается в том, что при взаимодействии гидратированного иона кадмия(II) с этилендиамином две молекулы лиганда вытесняют четыре молекулы воды. При этом число свободных частиц в системе значительно возрастает, и энтропия системы возрастает (а внутренняя упорядоченность комплекса соответствено растёт). То есть причина хелатного эффекта — увеличение энтропии системы при замещении монодентатных лигандов полидентатнымии и, как следствие, снижение энергии Гиббса.[2]
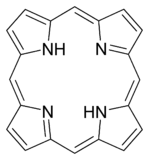
Среди хелатирующих лигандов можно выделить класс макроциклических лигандов — молекул с достаточным для помещения атома комплексообразователя размером внутрициклического пространства. Примером таких соединений могут служить порфириновые основания — основы важнейших биохимических комплексов, таких, как гемоглобин, хлорофилл и бактериохлорофилл. Также в качестве макроциклических лигандов могут выступать краун-эфиры, каликсарены и др.
Лиганды также могут являться мостиковыми, образуя связи между различными центральными атомами в би- или полиядерных комплексах. Мостиковые лиганды обозначаются греческой буквой μ (мю).
Примечания
В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 13 мая 2011.Структурная химия Химическая связь: Ароматичность | Ковалентная связь | Ионная связь | Металлическая связь | Водородная связь | Донорно-акцепторная связь | Таутомерия | Ван-дер-Ваальсова связь Отображение структуры: Функциональная группа | Структурная формула | Скелетная формула органических соединений | Химическая формула | Лиганд | Координационная геометрия | Координационная сфера Электронные свойства: Электроотрицательность | Сродство к электрону | Энергия ионизации | Полярность химических связей | Правило октета Стереохимия: Асимметрический атом | Изомерия | Конфигурация | Хиральность | Конформация Категории:- Биохимия
- Комплексные соединения
- Координационная геометрия
- Координационная химия
Wikimedia Foundation. 2010.