-
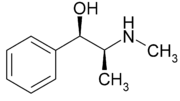 Химическая структура эфедрина — алкалоида, производного фенилэтиламина
Химическая структура эфедрина — алкалоида, производного фенилэтиламина- Не следует путать с Альдегид.
Алкалоиды — большая группа азотсодержащих органических соединений, обладающих свойствами слабого основания, часто имеющих достаточно сложную химическую структуру и выделяемых на основании не только химических признаков. Помимо углерода, водорода и азота в молекулы алкалоидов могут входить атомы серы, реже хлора или брома. Многие алкалоиды обладают выраженной физиологической активностью, большая часть алкалоидов имеет растительное происхождение, реже алкалоиды обнаруживаются в грибах и животных. Некоторые соединения, иногда относимые к алкалоидам, синтезированы и в естественных условиях не встречаются.
Такие соединения, как аминокислоты, пептиды, белки, нуклеотиды, нуклеиновые кислоты, аминосахара и антибиотики обычно не относят к алкалоидам.[1]
Содержание
Название
Название нем. Alkaloide введено в 1818 году немецким аптекарем Карлом Майснером (нем. Carl Meißner) и образовано от арабского al qualja — «пепел растений» или позднелатинского alcali — «щёлочь» и греческого oidos — «похожий (вид)».
По сложившейся традиции алкалоидам присваивают тривиальные названия, образуя индивидуальные названия алкалоидов присоединением суффикса «ин» к видовым или родовым названиям алкалоидоносов.
Например: атропин выделен из растения Белладонна (Atropa belladonna L.), стрихнин получен из рвотных орешков — семян дерева Чилибуха (Strychnos nux-vomica L.)История открытия и исследования
Изучение алкалоидов началось в XIX веке. В 1803 году были получены алкалоиды опия в виде смеси кристаллических веществ. В 1806 году из них был выделен первый индивидуальный алкалоид морфин. В последующие годы были открыты стрихнин, хинин, кофеин, атропин, эфедрин и другие. Первый синтез алкалоида осуществлён в 1873 году. К середине XX века было открыто более тысячи соединений. В настоящее время известно более 5000 алкалоидов и поиск новых алкалоидов продолжается, например, в морских организмах.
Классификация
Не существует единой классификации алкалоидов.
- Классификация, основанная на строении углеродного скелета молекулы, наиболее распространена и признана. Например: изохинолиновые, пептидные, пиридиновые, пуриновые, хиназолиновые, хинолиновые.
- Классификация по филогенетическому признаку основана на объединении в одну группу всех соединений, выделенных из общего источника, например из растений одного рода.
- Классификация по биогенетическим предшественникам, различает группы алкалоидов на основании участия в биосинтезе определённых соединений: орнитин, пролин, лизин, фенилаланин, триптофан, антраниловая кислота, гистидин. Такая классификация используется не часто, на её основе бывает невозможно однозначно отнести алкалоиды со сложной структурой к одной определённой группе.
Тип (базовое соединение) Основные группы Основные пути биосинтеза Представители Алкалоиды с азотистыми гетероциклами (истинные алкалоиды) Производные пирролидина[2] Орнитин или аргинин → путресцин → N-метилпутресцин → N-метил-Δ1-пирролин[3] Гигрин, гигролин, кускгигрин, стахидрин, турицин, бруссонетин[4][5] Производные пиперидина[6] Простые производные пиперидина[7] Лизин → кадаверин → Δ1-пиперидеин[8] Седамин[9] Группа кониина[10] Кониин, коницеин, конгидрин, пельтьерин[11] Группа лобелина[12] Лобелин, лобеланин[13][14] Производные пиридина[15] Простые производные пиридина[16] Никотиновая кислота → дигидроникотиновая кислота → 1,2-дигидропиридин[17] Тригонелин, рицинин, ареколин[18][19] Полициклические неконденсированные производные пиридина[20] Никотин, норникотин, анабазин, анатабин[21][22] Полициклические конденсированные производные пиридина[23] Актинидин, генцианин, педикулинин[24] Сесквитерпеноидные производные пиридина[25] Никотиновая кислота, изолейцин[26] Эвонин, гиппократеин, гипоглаунин, триптонин[27][28] Производные имидазола[29] Напрямую из гистидина[30] Гистамин, пилокарпин, долихотелин, пилозин, стивенсин[31][32] Производные тиазола[33] 1-деокси-D-ксилулозы-5-фосфат (DOXP), тирозин, цистеин[34] Аргохелин, ностоцикламид, тиострептон[35][36] Производные оксазола[37] (Тирозин → тирамин), кофейная кислота[38] Аннулолин, галфординол, тексалин, тексамин[39] Производные тропана[40] Группа атропина
Заместители в позициях 3,6 или 7[41]Орнитин или аргинин → путресцин → N-метилпутресцин → N-метил-Δ1-пирролин[42] Атропин, апоатропин, скополамин, гиосциамин[43][44][45] Группа кокаина
Заместители в позициях 2 и 3[46]Кокаин, экгонин[47][48] Производные пирролизидина[49] Неэфирные[50] Орнитин или аргинин → путресцин → гомоспермидин → ретронецин Ретронецин, гелиотридин, лабурнин[51][52] Сложные эфиры монокарбоновых кислот[53] Индицин, линделофин, саррацин[54] Макроциклические диэфиры[55] Платифиллин, триходесмин[56] Производные хинолизидина[57] Группа лупинина[58] Лизин → кадаверин → Δ1-пиперидеин[59] Лупинин, нуфаридин[60] Группа цитизина[61] Цитизин[62] Группа спартеина[63] Спартеин, лупанин, анагирин, пахикарпин[64] Группа матрина[65] Матрин, оксиматрин, алломатридин, софоранол[66][67][68] Группа ормозанина[69] Ормозанин, пиптантин[70][71] Группа 9b-азафеналена[72] Гиппоказин, конвергин, кочинеллин[73] Группа фенантрохинолизидина[74] Криптоплеврин, криптоплевридин[75] Свойства
Растворы алкалоидов имеют слабо щелочную реакцию. Большинство алкалоидов плохо растворимы в воде. Они, как правило, лучше растворимы в растворах неорганических кислот. При этом образуются лучше растворимые соли алкалоидов. Растворы солей алкалоидов, как правило, имеют кислую реакцию, в полном соответствии с законами диссоциации солей слабых оснований с сильными кислотами.
Многие алкалоиды сильно ядовиты, нередко они имеют горький вкус. Предполагается, что таким образом естественный отбор защитил животных от вырабатываемых растениями алкалоидов, в свою очередь обеспечивших защиту растения от поедания животными. В растениях алкалоиды могут откладываться в листьях, коре, корнях, семенах. Некоторые из этих ядовитых алкалоидов обладают в малых дозах теми или иными ценными фармакологическими свойствами, делающими возможным их медицинское применение.
Примерами алкалоидов, нашедших применение в медицине в виде чистых веществ, являются морфин, кокаин, кофеин, кодеин, хинин, стрихнин, атропин, галантамин, теин, теобромин, пахикарпин и другие.
Многие алкалоиды не выделены в чистом виде за ненадобностью и малоценностью для клинической практики, но содержащие эти алкалоиды растения продолжают широко использоваться в клинической практике. Примером является валериана, содержащая среди прочих веществ алкалоиды валерин и хатинин.
Примечания
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). Compiled by A. D. McNaught and A.Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 224
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 75
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — с. 33
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 224
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 225
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — с. 80
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 95
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — с. 80
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — с. 81
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — с. 81
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — с. 94
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — с. 94
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 7
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 227
- ↑ Химическая энциклопедия: Пиридиновые алкалоиды
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 107
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 227
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 85
- ↑ Химическая энциклопедия: Пиридиновые алкалоиды
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 227
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 85
- ↑ Химическая энциклопедия: Пиридиновые алкалоиды
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 228
- ↑ Химическая энциклопедия: Пиридиновые алкалоиды
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 110
- ↑ Химическая энциклопедия: Пиридиновые алкалоиды
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 107
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 241
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 104
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 241
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 104
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 242
- ↑ Tadhg P. Begley Encyclopedia of Chemical Biology: Cofactor Biosynthesis
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 242
- ↑ John R. Lewis Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids // Nat. Prod. Rep.. — 2000. — № 17. — С. 57—84.
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 241
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 35. — Academic Press, 1989. — p. 261
- ↑ Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 35. — Academic Press, 1989. — pp. 260-263
- ↑ Manfred Hesse. Alkaloids. Nature's Curse or Blessing. — Wiley-VCH, 2002. — p. 33.
- ↑ Химическая энциклопедия: Тропановые алкалоиды
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 75
- ↑ Химическая энциклопедия: Тропановые алкалоиды
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 224
- ↑ Manfred Hesse. Alkaloids. Nature's Curse or Blessing. — Wiley-VCH, 2002. — p. 34.
- ↑ Химическая энциклопедия: Тропановые алкалоиды
- ↑ Химическая энциклопедия: Тропановые алкалоиды
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 27
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 229
- ↑ Химическая энциклопедия: Пирролизидиновые алкалоиды
- ↑ Химическая энциклопедия: Пирролизидиновые алкалоиды
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 229
- ↑ Химическая энциклопедия: Пирролизидиновые алкалоиды
- ↑ Химическая энциклопедия: Пирролизидиновые алкалоиды
- ↑ Химическая энциклопедия: Пирролизидиновые алкалоиды
- ↑ Химическая энциклопедия: Пирролизидиновые алкалоиды
- ↑ Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — с. 230
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Tadeusz Aniszewski Alkaloids – secrets of life. — Amsterdam: 2007. — p. 98
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ J.E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 91.
- ↑ Joseph P. Michael Indolizidine and quinolizidine alkaloids // Nat. Prod. Rep.. — 2002. — № 19. — С. 458—475.
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ J.E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 92.
- ↑ Химическая энциклопедия: Хинолизидиновые алкалоиды
- ↑ Joseph P. Michael Indolizidine and quinolizidine alkaloids // Nat. Prod. Rep.. — 1999. — № 16. — С. 675—696.
- ↑ J.E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — p. 93.
- ↑ J.E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — pp. 93-95.
Литература
- Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — 859 с.
- Кунянц И. Л. Химическая энциклопедия. — М.: Советская эциклопедия, 1988. — Т. 1 абл-дар. — С. 83. — 623 с.
- Племенков В.В. Введение в химию природных соединений. — Казань: 2001. — 376 с.
- Tadeusz Aniszewski. Alkaloids – secrets of life. — Amsterdam: Elsevier, 2007. — 335 с. — ISBN 978-0-444-52736-3
- Tadhg P. Begley. Encyclopedia of Chemical Biology. — Wiley, 2009. — 3188 с. — ISBN 978-0-471-75477-0
- Arnold Brossi. The Alkaloids: Chemistry and Pharmacology, Volume 35. — Academic Press, 1989. — 335 с. — ISBN 0-12-469535-3
- Manfred Hesse. Alkaloids. Nature's Curse or Blessing. — Wiley-VCH, 2002. — 414 с. — ISBN 978-3-906390-24-6
- J.E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. — London: The Chemical Society, 1971. — 524 с.
Ссылки
- Энциклопедия КРУГОСВЕТ ® АЛКАЛОИДЫ
Алкалоиды Индол: Алкалоиды гармалы | Псилоцин | Псилоцибин | ДМТ | Буфотенин | ЛСД | Ибогаин | Резерпин | Триптамины | Йохимбин | Стрихнин | Бруцин Фенилэтиламин: Катинон | Адреналин | Норадреналин | Эфедрин | Мескалин | Амфетамин | Метамфетамин | МДМА | МДА | ДОБ | Пурин: Кофеин | Теобромин | Теофиллин Пиперидин: Кониин Пирролидин: Никотин Хинолин: Хинин Изохинолин: Кодеин | Морфин | Папаверин Тропан: Атропин | Кокаин | Гиосциамин | Скополамин Терпены: Аконитин | Соланин | Дельфинин Бетаин: Мускарин Пиразол:
Wikimedia Foundation. 2010.
