- Едкий натр
-
Гидроксид натрия 
Наименование едкий натр, каустик,
каустическая сода,
едкая щелочьХимическая формула Na-OH Молярная масса 39.9971 г/моль Температура плавления 323 °C Температура кипения 1403 °C Плотность вещества 2,02 г/см3 Растворимость в воде
— 52,2 (20 °C) г/100 млромбическая модификация до 299 °C Гидроксид натрия лат. Natrii hydroxidum; другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь. Самая распространенная щёлочь, химическая формула NaOH. В год в мире производится и потребляется более 57 миллионов тонн едкой щёлочи. Гидроксид натрия также используется для мойки пресс-форм автопокрышек, называется Mold Cleaner фирмы «NALCO». Интересна история тривиальных названий как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разьедать кожу, бумагу, стекло и вызывать сильные ожоги. До XVII века, щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda, из золы которого её добывали), а карбонат калия — поташем. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Содержание
Физические свойства
Термодинамика растворов
ΔH0 растворения для бесконечно разбавленного водного раствора —44,45 кДж/моль.
Из водных растворов при 12,3 — 61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH0обр −734,96 кДж/моль), в интервале от —28 до —24°С — гептагидрат, от —24 до —17,7°С — пентагидрат, от —17,7 до —5,4°С —тетрагидрат (α-модификация), от —5,4 до 12,3 °C. Растворимость в метаноле 23,6 г/л (t=28 °C), в этаноле 14,7 г/л (t=28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Химические свойства
Гидроксид натрия (едкая щёлочь)— сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочно-земельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкий калий), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдает электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в ряду электрохимической активности металлов, в котором за ноль принята активность водорода.

Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13). Основными методами определения щелочей в растворах являются реакции на гидроксильную группу (OH-), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксилов находится в растворе, тем сильнее щелочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твердых веществ:
(в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH- + H3O+ → 2H2O.)
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твердыми при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O
так и с растворами:
ZnO + 2NaOH(раствор) + H2O → Na2[Zn(OH)4](раствор)+H2
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
- с кислотными оксидами — с образованием солей; это свойство используется для очистки промышленных выбросов от кислотных газов (например: CO2, SO2 и H2S):
2NaOH + CO2 → NaHCO3 + NaOH → Na2CO3 + H2O
2Na+ + CO3- + H+ + OH- → NaHCO3 + Na+ + OH- → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
(1) H2S + 2NaOH = Na2S + 2H2O (при избытке NaOH)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
2. Обмена с солями в растворе:
2NaOH +CuSO4 → Cu (OH)2↓ + Na2SO4,
2Na+ + 2OH- + Cu2+ + SO42- → Cu(OH)2↓+ Na2SO4
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе. Его и используют, в частности, для очистки воды от мелких взвесей.
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4.
6Na+ + 6OH- + 2Al3+ + SO42- → 2Al(OH)3↓ + 3Na2SO4.
3. С неметаллами:
например, с фосфором — с образованием гипофосфита натрия:
4Р + 3NaOH + 3Н2О → РН3 + 3NaН2РО2.
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
- с галогенами:
2NaOH + Cl2 → NaClO + NaCl + H2O(дисмутация хлора)
2Na+ + 2OH- + 2Cl- → 2Na+ + 2O2- + 2H+ + 2Cl- → NaClO + NaCl + H2O
6NaOH + 3I2 → NaIO3 + 5NaI + 3H2O
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
2Al0 + 2NaOH + 6H2O → 3H2↑ + 2Na[Al(OH)4]
2Al0 + 2Na+ + 8OH- + 6H+ → 3H2↑ + 2Na+[Al3+(OH)-4]-
5. С эфирами, амидами и алкилгалогенидами (гидролиз):
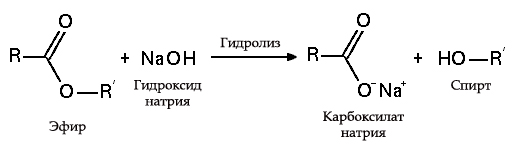 Гидролиз эфиров
Гидролиз эфиров- с жирами (омыление), такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путем вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века:
(C17H35COO)3C3H5 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
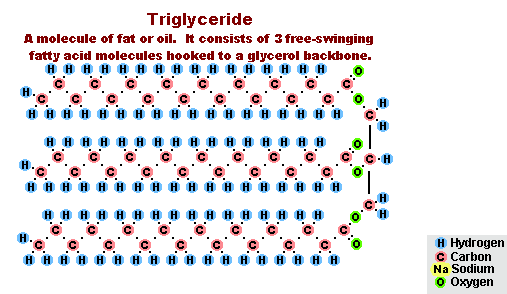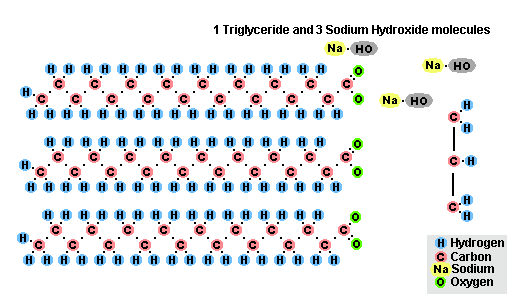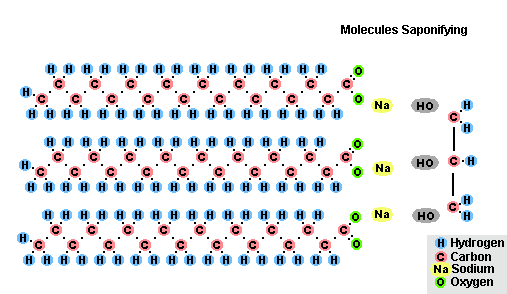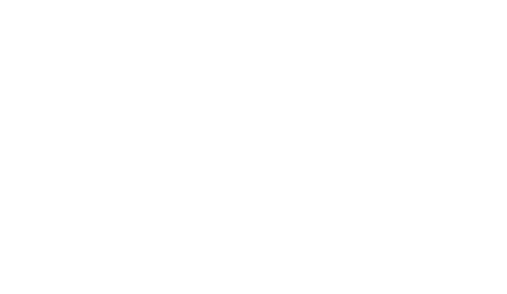 Процесс омыления жиров
Процесс омыления жировВ результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
HO-CH2-CH2ОН + 2NaOH → NaO-CH2-CH2-ONa + 2Н2O
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
SiO2 + 4NaOH → (2Na2O)·SiO2 + 2H2O.
Качественное определение ионов натрия возможно несколькими способами
 Ионы натрия придают пламени жёлтую окраску
Ионы натрия придают пламени жёлтую окраску1. По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску:
2. С использованием специфических реакций на ионы натрия:
Реагент Фторид аммония Нитрит цезия-калия-висмута Ацетат магния Ацетат цинка Пикро- лоновая кислота
Диокси- винная кислота
Бромбензол- сульфокислота
Цвет осадка белый бледно-жёлтый жёлто-зеленый желто-зеленый белый белый бледно-жёлтый Способы получения
Промышленные способы получения
В промышленном масштабе гидроксид натрия получают электролизом растворов галита (каменная соль NaCl) с одновременным получением водорода и хлора:
- 2NaCl + 2H2О = H2↑ + Cl2↑ + 2NaOH,
В настоящее время едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них - электролиз с твёрдым асбестовым или полимерным катодом (диафрагменный и мембранный методы производства), третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым лёгким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, наименее энергоёмкий и наиболее экологичный, но и самый капризный, в частности, требует сырьё более высокой чистоты.
Едкие щёлочи, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом. Для некоторых производств это важно. Так, в производстве искусственных волокон можно применять только каустик, полученный при электролизе с жидким ртутным катодом. В мировой практике используются все три метода получения хлора и каустика, при явной тенденции в сторону увеличения доли мембранного электролиза. В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Эффективность процесса производства рассчитывается не только по выходу едкого натра, но и по выходу хлора и водорода, получаемых при электролизе, соотношение хлора и гидроксида натрия на выходе 100/110, реакция протекает в следующих соотношениях:
- 1,8 NaCl + 0, 5 H2O + 2,8 МДж = 1,00 Cl2 + 1,10 NaOH + 0,03 H2,
Основные показатели различных методов производства даны в таблице:
Показатель на 1 тонну NaOH Ртутный метод Диафрагменный метод Мембранный метод Выход хлора % 97 96 98,5 Электроэнергия (кВт·ч) 3 150 3 260 2 520 Концентрация NaOH 50 12 35 Чистота хлора 99,2 98 99,3 Чистота водорода 99,9 99,9 99,9 Массовая доля O2 в хлоре, % 0,1 1—2 0,3 Массовая доля Cl- в NaOH, % 0,003 1—1,2 0,005 Технологическая схема электролиза с твёрдым катодом
Диафрагменный метод — Полость электролизёра с твёрдым катодом разделена пористой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом [1]. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды — водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь:
- 2Cl- − 2е = Cl20,
- H2O − 2e − 1/2 О2 = H2↑.
При этом прикатодная зона обогащается гидроксидом натрия. Раствор из прикатодной зоны, называемый электролитическим щёлоком, содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42—50 % в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат. Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Мембранный метод — аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
Технологическая схема ртутного электролиза. Основная технологическая стадия — электролиз, основной аппарат — электролитическая ванна, которая состоит из электролизёра, разлагателя и ртутного насоса, объединенных между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течёт поток анолита — раствор галита. В результате электрохимического разложения галита на аноде образуются ионы Cl- и выделяется хлор:
- 2 Cl- — 2е = Cl20↑,
который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама:
Na+ + е = Na0 nNa+ + nHg- = Na + Hg Амальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Na + Hg + Н20 = NaOH + 1/2Н2↑ + Hg Полученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита, вредной в производстве вискозы. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Лабораторные способы получения
В лаборатории гидроксид натрия получают химическими способами, которые имеют больше историческое, чем практическое значение.
Известковый способ получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80 °C . Этот процесс называется каустификацией; он описывается реакцией:
Na2C03 + Са (ОН)2 = 2NaOH + CaC03 В результате реакции образуется раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
Na2C03 + Fe203 = Na20 • Fe203 + C02 (1) Na20 • Fe203 -f H20 = 2 NaOH + Fe2O3 (2) (1) — процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек-феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (2); получается раствор гидроксида натрия и осадок Fe2O3, который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % NaOH.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнен примесями, обслуживание аппаратов трудоемко. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства.
Рынок каустической соды
Мировое производство натра едкого, 2005 год Производитель Обьем производства, млн.тонн Доля в мировом производстве DOW 6.363 11.1 Occidental Chemical Company 2.552 4.4 Formosa Plastics 2.016 3.5 PPG 1.684 2.9 Bayer 1.507 2.6 Akzo Nobel 1.157 2.0 Tosoh 1.110 1.9 Arkema 1.049 1.8 Olin 0.970 1.7 Россия 1.290 2.24 Китай 9.138 15.88 Другие 27.559 47,87 Всего: 57,541 100 В России согласно ГОСТ 2263-79 производятся следующие марки натра едкого: ТР — твердый ртутный (чешуированный);
ТД — твердый диафрагменный (плавленый);
РР — раствор ртутный;
РХ — раствор химический;
РД — раствор диафрагменный.
Наименование показателя ТР ОКП 21 3211 0400 ТД ОКП 21 3212 0200 РР ОКП 21 3211 0100 РХ 1 сорт ОКП 21 3221 0530 РХ 2 сорт ОКП 21 3221 0540 РД Высший сорт ОКП 21 3212 0320 РД Первый сорт ОКП 21 3212 0330 Внешний вид Чешуирова- нная масса белого цвета. Допускается слабая окраска Плавленая масса белого цвета. Допускается слабая окраска Бесцветная прозрачная жидкость Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок Массовая доля гидроксида натрия, %, не менее 98,5 94,0 42,0 45,5 43,0 46,0 44,0 Показатели российского рынка жидкого натра едкого в 2005—2006 г. Наименование предприятия 2005 г. тыс.тонн 2006 г. тыс.тонн доля в 2005 г.% доля в 2006 г.% ОАО «Каустик», Стерлитамак 239 249 20 20 ОАО «Каустик», Волгоград 210 216 18 18 ОАО «Саянскхимпласт» 129 111 11 9 ООО «Усольехимпром» 84 99 7 8 ОАО «Сибур-Нефтехим» 87 92 7 8 ОАО «Химпром», Чебоксары 82 92 7 8 ВОАО «Химпром», Волгоград 87 90 7 7 ЗАО «Илимхимпром» 70 84 6 7 ОАО «КЧХК» 81 79 7 6 НАК «АЗОТ» 73 61 6 5 ОАО «Химпром», Кемерово 42 44 4 4 Итого: 1184 1217 100 100 Показатели российского рынка твердого натра едкого в 2005—2006 г. Наименование предприятия 2005 г. тонн 2006 г. тонн доля в 2005 г.% доля в 2006 г.% ОАО «Каустик», Волгоград 67504 63510 62 60 ОАО «Каустик», Стерлитамак 34105 34761 31 33 ОАО «Сибур-Нефтехим» 1279 833 1 1 ВОАО «Химпром», Волгоград 5768 7115 5 7 Итого: 108565 106219 100 100 Применение
 Биодизельное топливоТреска Lutefisk на праздновании Дня Конституции Норвегии
Биодизельное топливоТреска Lutefisk на праздновании Дня Конституции Норвегии Немецкий рогалик
Немецкий рогаликЕдкий натр применяется в огромном множестве отраслей промышленности и для бытовых нужд:
- Каустик применяется в целлюлозно-бумажной промышленности для делигнификации (Реакция Крафта) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.,
- Для омыления жиров при производстве мыла, шампуня и других моющих средств. В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда хорошо моется. О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 г. н. э. Теодор Присцианус. Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад.
- В химических отраслях промышленности — для нейтрализации кислот и кислотных окислов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке — для производства масел.
- Для изготовления биодизельного топлива — получаемого из растительных масел и используемого для замены обычного дизельного топлива. Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9 :1), а также щелочной катализатор (NaOH).
Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число условная количественная характеристика самовоспламеняемости дизельных топлив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьем для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности, либо перерабатываетс я в эпихлоргидрин по методу агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей. Гидроксид натрия дезагрегирует засор и способствует легкому продвижению его далее по трубе.
 Получение биодизеля
Получение биодизеля
- В гражданской обороне для дегазации и нейтрализации отравляющих веществ, в том числе зарина, в ребризерах (изолирующих дыхательных аппаратах (ИДА), для очистки выдыхаемого воздуха от углекислого газа.
- Гидроксид натрия также используется для нелегального производства метамфетаминов и других наркотических средств.
- В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E524.
Некоторые блюда готовятся с применением каустика:
-
- Lutefisk — скандинавское блюдо из рыбы — сушеная треска вымачивается 5-6 дней в едкой щелочи и приобретает мягкую, желеобразную консистенцию.
-
- Pretzel (Немецкие рогалики) — перед выпечкой их обрабатывают в растворе едкой щелочи которая способствует образованию уникальной хрустящей корочки.
Меры предосторожности при обращении с гидроксидом натрия
Гидроксид натрия — едкое и коррозионноактивное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьезные химические ожоги. При контакте слизистых поверхностей с едкой щелочью необходимо промыть пораженный участок струей воды, а при попадании на кожу слабым раствором уксусной кислоты. При работе с едким натрием рекомендуется следующие защитные средства: химические брызгозащитные очки для защиты глаз, резиновые перчатки или перчатки с прорезиненной поверхностью для защиты рук, для защиты тела, химически-стойкая одежда пропитанная винилом или прорезиненные костюмы.
ПДК гидроксида натрия в воздухе 0,5 мг/м³.
Литература
- Общая химическая технология . Под ред. И. П. Мухленова. Учебник для химико-технологических специальностей вузов. — М.: Высшая школа.
- Основы общей химии, т. 3, Б. В. Некрасов. — М.: Химия, 1970.
- Общая химическая технология. Фурмер И. Э., Зайцев В. Н. — М.: Высшая школа, 1978.
- Приказ Минздрава РФ от 28 марта 2003 г. N 126 «Об утверждении Перечня вредных производственных факторов, при воздействии которых в профилактических целях рекомендуется употребление молока или других равноценных пищевых продуктов».
- Постановление Главного государственного санитарного врача РФ от 4 апреля 2003 г. N 32 «О введении в действие Санитарных правил по организации грузовых перевозок на железнодорожном транспорте. СП 2.5.1250-03».
- Федеральный закон от 21.07.1997 N 116-ФЗ «О промышленной безопасности опасных производственных объектов» (с изменениями на 18 декабря 2006 года).
- Приказ МПР РФ от 2 декабря 2002 г. N 786 «Об утверждении федерального классификационного каталога отходов» (с изм. и доп. от 30 июля 2003 г.).
- Постановление Госкомтруда СССР от 25.10.1974 N 298/П-22 «Об утверждении списка производств, цехов, профессий и должностей с вредными условиями труда, работа в которых дает право на дополнительный отпуск и сокращенный рабочий день» (с изменениями на 29 мая 1991 года).
- Постановление Минтруда России от 22.07.1999 N 26 «Об утверждении типовых отраслевых норм бесплатной выдачи специальной одежды, специальной обуви и других средств индивидуальной защиты работникам химических производств».
- Постановление Главного государственного санитарного врача РФ от 30.05.2003 N 116 О введении в действие ГН 2.1.6.1339-03 «Ориентировочные безопасные уровни воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населенных мест».(с изменениями на 3 ноября 2005 года).
- ГОСТ 2263-79* Натр едкий технический. Технические условия.
Wikimedia Foundation. 2010.


