- Вторичная структура белков
-
Вторичная структура — конформационное расположение главной цепи (англ. backbone) макромолекулы (например, полипептидная цепь белка), независимо от конформации боковых цепей или отношения к другим сегментам [1]. В описании вторичной структуры важным является определение водородных связей, которые стабилизируют отдельные фрагменты макромолекул.
Содержание
Регулярные вторичные структуры белка
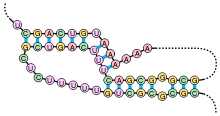
 Вид сбоку альфа-спирали созданной из остатков аланина. Водородные связи обозначены красно-фиолетовым цветом.
Вид сбоку альфа-спирали созданной из остатков аланина. Водородные связи обозначены красно-фиолетовым цветом.
Вторичные структуры отличаются регулярной, периодической формой (конформацией) главной цепи, при разнообразии конформаций боковых групп.
- α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[2] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[2]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
- π-спирали;
- 310-спирали;
- неупорядоченные фрагменты.
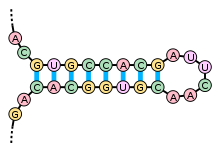
Вторичная структура РНК
Примерами вторичной структуры могут служить стебель-петля и псевдоузел [3]
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3' нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов.
В вирусных мРНК сложные вторичные структуры (IRES) направляют трансляцию, не зависящую от узнавания кэпа и факторов инициации трансляции (см. «Инициация трансляции»).
См. также
- Первичная структура
- Третичная структура
- Четвертичная структура
- Парадокс Левинталя
Примечания
Категории:- Стереохимия
- Структурная геномика
Wikimedia Foundation. 2010.