- Е284
-
Борная кислота 
Общие Систематическое наименование Ортоборная кислота Химическая формула H3BO3 Отн. молек. масса 61,83 а. е. м. Молярная масса 61,83 г/моль Физические свойства Плотность вещества 1,435 (15 °C) г/см³ Состояние (ст. усл.) твёрдое Термические свойства Температура плавления 171 (разл.) °C Химические свойства pKa 9,24 (I), 12,74 (II), 13,80 (III) Растворимость в воде 5,74 (25 °C) г/100 мл Классификация номер CAS 10043-35-3
Бо́рная кислота́ (ортоборная кислота)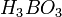 — слабая кислота.
— слабая кислота.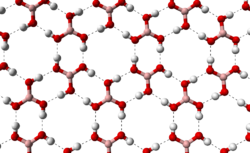 структура плоского слоя в ортоборной кислоте
структура плоского слоя в ортоборной кислотеБесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решетку, в которой молекулы
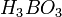 соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).Метаборная кислота
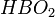 также предствляет собой бесцветные кристаллы. Она существует в трех модификациях - наиболее устойчивой γ-НВО2 с кубической решеткой, β-НВО2 с моноклинной решеткой и α-НВО2 с ромбической решеткой.
также предствляет собой бесцветные кристаллы. Она существует в трех модификациях - наиболее устойчивой γ-НВО2 с кубической решеткой, β-НВО2 с моноклинной решеткой и α-НВО2 с ромбической решеткой.При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту
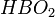 , затем в тетраборную
, затем в тетраборную 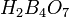 . При дальнейшем нагревании обезвоживается до борного ангидрида.
. При дальнейшем нагревании обезвоживается до борного ангидрида.Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n.
Содержание
Свойства
- Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Ее кислотные свойства обусловлены не отщеплением протона Н+, а присоденением гидроксиданиона:
-
- B(OH)3 + H2O → B(OH)4− + H+
- Ka = 5.8x10−10 моль/л; pKa = 9.24.
- B(OH)3 + H2O → B(OH)4− + H+
- Она легко вытесняется из растворов своих солей большинством других кислот. Соли ее, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего – тетраборной Н2В4О7, которая является значительно более сильной ксилотой, чем ортоборная.
- Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(НSO4)3.
- При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3–, поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4]–. В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
-
- 2NaOH + 4Н3ВО3 → Na2B4O7 + 7Н2О
- Избытком щелочи они могут быть переведены в метабораты:
- 2NaOH + Na2B4O7 → 4NaBO2 + Н2О
- Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведенным).
- В подкисленных водных растворах боратов устанавливаются следующие равновесия:
- 3Н[В(ОН)4] ↔ Н+ + [В3О3(ОН)4]– + 5Н2O
- [В3О3(ОН)4]– + ОН– ↔ [В3О3(ОН)5]2–
- Наиболее распространенной солью борной кислоты является декагидрат тетрабората натрия, Na2B4O7 · 10H2O) (техническое название – бура).
- При нагревании борная кислота растворяет оксиды металлов, образуя соли.
- Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
-
- Н3ВО3 + 3CH3OH → 3H2O + B(OCH3)3
- Образование борнометилового эфира В(ОСН3)3 является качественной реакцией на Н3ВО3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зеленым пламенем.
Нахождение в природе
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Применение
- Борное удобрение
- В лабораториях применяют для приготовления буферных растворов
- В медицине — как самостоятельное дезинфицирующее средство. Также на основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например, паста Теймурова.
- В фотографии — в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
- В быту раньше использовалась для борьбы с тараканами.
- В пищевой промышленности — зарегистрирована как пищевая добавка E284 (на территории России эта добавка не входит в список разрешённых к применению[1]).
- В игре Новус борной кислотой натирают игровой стол для лучшего скольжения фишек.
Литература
- Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия 1994
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
Примечания
См. также
Wikimedia Foundation. 2010.
