- Е249
-
Нитрит калия 
Основные свойства Систематическое
названиеPotassium nitrite(англ.) (ИЮПАК)
Нитрит калияСинонимы - Уникальный ACSII идентификатор - Химическая формула KNO2 Молярная масса 85.10 грамм/моль Существует при
нормальных условиях какбелый или желтоватый кристаллический порошок Регистрационный
номер CAS7758-09-0 Свойства Плотность и
фазатвердая фаза: 1.92 г/см³ Растворимость в воде 281 гр/100 мл (20 °C) Дополнительно Температура плавления -
441°C
Разлагается до достижения точки кипения ,,Если не оговорено иное,- приведены данные в
стандартных условиях(при 25 °C, 100 кПа)Нитри́т ка́лия (устар. калий азотистокислый),- KNO2, калиевая соль азотистой кислоты используется как улучшитель окраски и консервант в пищевой промышленности в изделиях из мяса и рыбы. Пищевая добавка E249. Очищенный нитрит калия представляет собой белый или слегка желтоватый кристаллический порошок. Очень хорошо растворим в воде и гигроскопичен. На воздухе медленно доокисляется до нитрата калия КNO3.
Содержание
Свойства
Нитрит калия представляет собой бесцветные или слегка желтоватые высоко гигроскопичные кристаллы, при растворении в воде понижает ее температуру, раствор имеет слабо щелочную реакцию. Плотность 1.92 г/см³. Очень хорошо растворим в воде (при 20 °C 281 г на 100 мл воды, при 100°C — 413 г на 100 мл воды). Кристаллы разрушаются при 360 °C (до достижения точки плавления которая равна 440 °C или 441 °C, при 100 КПа по данным польской и английской Википедии и 438 °C при давлении в 101325 Па[1], энтальпия плавления — 17 кДж/моль[1]).Выше этой температуры разлагается по пути

Как и нитрит натрия является окислителем особенно при повышенных температурах и реагирует с металлами такими как алюминий (особенно в порошкообразной форме), обезвоженными соединениями аммония такими как сульфат аммония, цианидами и многими органическими соединениями. На воздухе медленно доокисляется до нитрата калия
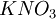

Нитриты можно выявить по характеристической реакции с сульфатом железа (II) в присутствии концентрированной серной кислоты (по образованию коричневого окраса).
Нахождение в естественных условиях и способы получения
В природе, нитриты появляются на промежуточных этапах азотного цикла — как при нитрификации (присоединении азота к соединениям) так и при денитрификации (отсоединении азота от соединений). В промышленности нитрит калия получают при реакции оксидов азота с гидроксидом калия. Также получается при окислении свинца нитратом калия

или в процессе термического разложения

Применение
- Нитрит калия как пищевая добавка Е249 (консервант) используется аналогично другим нитритам и солям (хлоридом натрия и нитритом натрия),- предотвращает образование ботулотоксина (образуется при жизнедеятельности палочки Clostridium botulinum). При добавлении к мясу образует нитрозомиоглобин имеющий характерный красный цвет который можно наблюдать в большинстве продуктов питания (колбасы, сосиски, и др.). Вызывает жажду при употреблении продуктов содержащих нитрит калия.
- Нитрит калия применяется для нитрирования при производстве азо-красителей,
- Нитрит калия применяется в аналитической химии для распознавания аминов,
- Нитрит калия применяется в фотографии как сенсибилизатор
Биологическое действие
Нитрит калия является общеядовитым веществом, при дозе в 200 мг на килограмм веса 50 % подопытных кроликов гибнет. Он нитрифицирует амины при нормальных условиях с образованием канцерогенов (нитрозоаминов). Из-за возможных пагубных последствий воздействия нитритов, их применение для консервирования не рекомендуется, однако не всегда возможно подобрать адекватную безопасную замену.
Примечания
- ↑ 1 2 Физические величины: Справочник/А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.; Энергоатомиздат, 1991 −1232 с — ISBN 5-283-04013-5
См. также
Wikimedia Foundation. 2010.
