- Пинаконы
-
Пинаконы — тетразамещенные этан-1,2-диолы общей формулы R2C(OH)–С(OH)R2, простейший представитель - пинакон (тетраметилэтан-1,2-диол), давший название этому классу гем-диолов[1].
Реакционная способность
Пинаконы - бесцветные кристаллические вещества, хорошо растворимые в этаноле и хлороформе и плохо растворимые в воде. Пинаконы образуют ассоциаты с водой и из водных растворов часто кристаллизуются в виде гидратов, так, пинакон при кристаллизации из горячей воды выпадает в виде гексагидрата (пинаконгидрата). Реакционная способность сходна с реакционной способностью третичных спиртов - они алкилируются, восстанавливаются йодистоводородной кислотой и т.п.
Специфической особенностью пинаконов являются реакции с перестройкой углеродного скелета.
Так, при нагревании пинаконы способны разлагаться с разрывом центральной связи на кетон и вторичный спирт, в случае бензпинакона (тетрафенилэтан-1,2-диола) такое разложение происходит уже при температуре плавления:
- Ph2C(OH)–С(OH)Ph2
 Ph2CO + Ph2CHOH
Ph2CO + Ph2CHOH
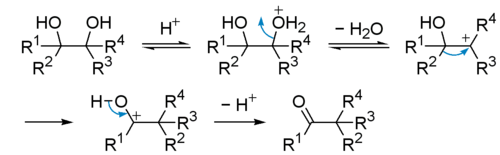
Под действием сильных кислот пинаконы претерпевают перегруппировку типа Вагнера-Меервейна в кетоны (пинаколины) с миграцией одного из заместителей (пинаколиновая перегруппировка):
Синтез
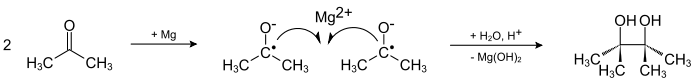
Исторически первым методом синтеза пинаконов является конденсация кетонов при их одноэлектронном восстановлении, идущая через промежуточное образование анион-радикальных интермедиатов - кетилов, эта реакция является классическим методом синтеза пинаконов и в настоящее время:
Восстановление кетонов в пинаконы производят в апротонных неполярных растворителях (бензол, толуол, тетрагидрофуран), используя в качестве восстановителей двухвалентные металлы либо амальгамы магния[2] и алюминия, так как использование двухвалентных металлов повышает выходы пинаконов за счет координации двух кетильных анион-радикалов у катиона металла.
Специфическим методом синтеза ароматических пинаконов является фотохимическое восстановление диарилкетонов изопропанолом под действием ультрафиолетового излучения, в случае бензофенона выходы бензпинакона составляют 93-95%[3]:
- 2 Ph2CO + (CH3)2CHOH
 Ph2C(OH)–C(OH)Ph2 + (CH3)2CO
Ph2C(OH)–C(OH)Ph2 + (CH3)2CO
Другой метод синтеза пинаконов – взаимодействие реактивов Гриньяра с α-дикетонами или легкодоступными сложными эфирами щавелевой кислоты. При использовании α-дикетонов образуются пинаконы с различными заместителями у спиртовых атомов углерода:- RCO–COR + R1MgHal
 RR1C(OH)–C(OH)RR1 ,
RR1C(OH)–C(OH)RR1 ,
в случае использования алкилоксалатов образуются пинаконы с одинаковыми заместителями у спиртовых атомов углерода:
- ROCO–COOR + R1MgHal
 R12C(OH)–C(OH)R12
R12C(OH)–C(OH)R12
Пинаконы также могут быть синтезированы из тетраалкилэтиленов - как прямым окислением:
- RR1C=CRR1 + [O]
 RR1C(OH)–C(OH)RR1 ,
RR1C(OH)–C(OH)RR1 ,
так и галогенированием с последующим гидролизом тетраалкилдигалогенэтанов:
- RR1C=CRR1 + Br2
 RR1CBr–CBrRR1
RR1CBr–CBrRR1 - RR1CBr–CBrRR1 + 2 OH-
 RR1C(OH)–C(OH)RR1 + 2 Br-
RR1C(OH)–C(OH)RR1 + 2 Br-
Примечания
- ↑ pinacols // IUPAC Gold Book
- ↑ Roger Adams and E. W. Adams. Pinacol hydrate. Organic Syntheses, Coll. Vol. 1, p.459 (1941); Vol. 5, p.87 (1925).
- ↑ W. E. Bachmann. Benzopinacol. Organic Syntheses, Coll. Vol. 2, p.71 (1943); Vol. 14, p.8 (1934).
 Категории:
Категории:- Терминология IUPAC
- Спирты
- Ph2C(OH)–С(OH)Ph2
Wikimedia Foundation. 2010.