- Иодноватая кислота
-
Иодноватая кислота 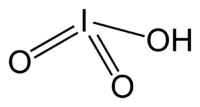

Общие Систематическое наименование Иодноватая кислота Химическая формула HIO3 Физические свойства Состояние (ст. усл.) бесцветные ромбические кристаллы Отн. молек. масса 175.91 а. е. м. Молярная масса 175.91 г/моль Плотность 4.62 (кр) г/см³ Термические свойства Температура плавления 110 °C Энтальпия образования (ст. усл.) -243,1 кДж/моль Химические свойства pKa 0.75 Растворимость в воде 269 г/100 мл Классификация Рег. номер CAS [7782-68-5] Иоднова́тая кислота́ HIO3 — бесцветное кристаллическое вещество, со стеклянным блеском и горьковато-кислым вкусом, устойчивое при обычной температуре. Легко образуется в кристаллическом состоянии в виде двух различных, не переходящих друг в друга форм ромбической сингонии.
Содержание
Свойства
Иодноватая кислота хорошо растворима в воде, в концентрированных растворах проявляется ее склонность к полимеризации и устанавливается равновесие:
- nHIO3 → (HIO3)n, n=2,3
При медленном нагревании она частично плавится при 110оС, частично образует ангидроиодноватую кислоту HI3O8.
При нагревании HIO3 до 230 °C образуется порошок иодноватого ангидрида, обладающего сильными окислительными свойствами, – I2O5, который растворяется в воде, вновь образуя иодноватую кислоту:
- 2HIO3 → I2O5 + H2O
Иодноватая кислота — сильная одноосновная кислота, обладает окислительными свойствами: E0(HIO3/I2) = 1,19 В.
- HIO3 + 5HI → 3I2 + 3H2O
Иодаты
Соли иодноватой кислоты называют иодатами. Иодаты разлагаются только выше 400 °C. Они обладают сильными окислительными свойствами. При взаимодействии с иодидами в кислой среде, иодаты выделяют элементный иод.
Получение
Получают в водных растворах при окислении иода хлором, перекисью водорода либо дымящей азотной кислотой:
- I2 + 5Cl2 + 6Н2О = 2HIO3 + 10HCl
- I2 + 5H2O2 = 2HIO3 + 4H2O
- I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
Литература
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
 Категории:
Категории:- Неорганические кислородсодержащие кислоты
- Соединения иода
Wikimedia Foundation. 2010.
