- ИЗОМЕРИЯ МОЛЕКУЛ
- ИЗОМЕРИЯ МОЛЕКУЛ
-
явление, состоящее в существовании молекул, обладающих одинаковой мол. массой и составом, но различающихся по строению или расположению атомов в пр-ве и, следовательно, по хим. и физ. св-вам. Такие молекулы наз. и з о м е р а м и. Существуют два вида И. м.— структурная и конформационная. Структурными изомерами наз. соединения, характеризующиеся одинаковыми хим. ф-лами, но разными структурными ф-лами. Так, нормальный бутан и изобутан при одинаковых ф-лах (С4Н10) имеют разные структурные ф-лы: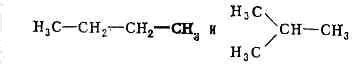 и явл. изомерными соединениями.Молекулы структурных изомеров — разные молекулы, и их взаимопревращение невозможно без разрыва хим. связей. Если при к.-л. условиях наблюдают переходы между структурными изомерами, то последние наз. т а у т о м е р а м и.Особым типом структурной И. м. явл. оптическая изомерия. Оптич. изомеры (т. н. э н а н т и о м е р ы) возникают в том случае, когда молекула содержит атом, являющийся киральным, т. е. молекула должна иметь асимметричный центр, напр. асимметричный тетраэдрич. атом С (см. СИММЕТРИЯ МОЛЕКУЛЫ), заместители к-рого могут быть расположены двумя зеркально-симметричными способами. Так, в изомерах молекулы фторхлорбромметана заместители при тетраэдрич. атоме углерода (Н, F, Cl и Br) расположены зеркально-симметричным способом. Оптич. изомеры имеют одинаковые физ. св-ва, за исключением того, что они вращают плоскость поляризации света в противоположные стороны, т. е. явл. оптически активными веществами.
и явл. изомерными соединениями.Молекулы структурных изомеров — разные молекулы, и их взаимопревращение невозможно без разрыва хим. связей. Если при к.-л. условиях наблюдают переходы между структурными изомерами, то последние наз. т а у т о м е р а м и.Особым типом структурной И. м. явл. оптическая изомерия. Оптич. изомеры (т. н. э н а н т и о м е р ы) возникают в том случае, когда молекула содержит атом, являющийся киральным, т. е. молекула должна иметь асимметричный центр, напр. асимметричный тетраэдрич. атом С (см. СИММЕТРИЯ МОЛЕКУЛЫ), заместители к-рого могут быть расположены двумя зеркально-симметричными способами. Так, в изомерах молекулы фторхлорбромметана заместители при тетраэдрич. атоме углерода (Н, F, Cl и Br) расположены зеркально-симметричным способом. Оптич. изомеры имеют одинаковые физ. св-ва, за исключением того, что они вращают плоскость поляризации света в противоположные стороны, т. е. явл. оптически активными веществами.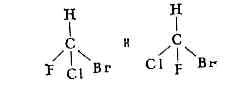 Конформационная изомерия связана с различием пространств. форм (к о н ф о р м е р о в) одной и той же молекулы. Конформеры, возникающие при вращении ат. групп вокруг хим. связей и отвечающие разным минимумам потенц. поверхности (см. МОЛЕКУЛА), наз. поворотными изомерами (или ротамерами), а о соответствующем явлении говорят как о поворотной И. м. Если же взаимопревращения изомеров происходят при одноврем. вращении вокруг неск. связей в циклич. молекулах или при изменении нек-рых валентных углов, то И. м. наз. и н в е р с и о н н о й. Так, молекула 1,2-дихлорэтана существует в виде двух ротамеров:
Конформационная изомерия связана с различием пространств. форм (к о н ф о р м е р о в) одной и той же молекулы. Конформеры, возникающие при вращении ат. групп вокруг хим. связей и отвечающие разным минимумам потенц. поверхности (см. МОЛЕКУЛА), наз. поворотными изомерами (или ротамерами), а о соответствующем явлении говорят как о поворотной И. м. Если же взаимопревращения изомеров происходят при одноврем. вращении вокруг неск. связей в циклич. молекулах или при изменении нек-рых валентных углов, то И. м. наз. и н в е р с и о н н о й. Так, молекула 1,2-дихлорэтана существует в виде двух ротамеров: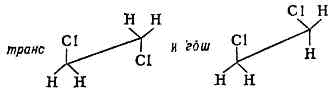 Транс-ротамер стабильнее гош-изомера, а энергетич. барьер, разделяющий их, равен 13 кДж/моль. Молекула аммиака существует в виде двух одинаковых пирамидальных и н в е р т о м е р о в, превращающихся друг в друга через плоскую форму:
Транс-ротамер стабильнее гош-изомера, а энергетич. барьер, разделяющий их, равен 13 кДж/моль. Молекула аммиака существует в виде двух одинаковых пирамидальных и н в е р т о м е р о в, превращающихся друг в друга через плоскую форму: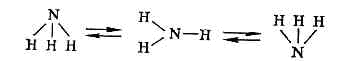 Барьер инверсии аммиака (разность энергий плоской и пирамидальной форм) равен 25 кДж/моль.Энергетич. барьеры, разделяющие конформеры, при норм. темп-pax не превышают 100 кДж/моль, а времена их жизни обычно =10-10 —10-13 с. Если же величина барьера существенно выше, то взаимопревращения невозможны (статистически крайне редки) и соответствующие изомеры наз. геометрическими. Напр., геом. изомеры 1,2-дихлорэтилена
Барьер инверсии аммиака (разность энергий плоской и пирамидальной форм) равен 25 кДж/моль.Энергетич. барьеры, разделяющие конформеры, при норм. темп-pax не превышают 100 кДж/моль, а времена их жизни обычно =10-10 —10-13 с. Если же величина барьера существенно выше, то взаимопревращения невозможны (статистически крайне редки) и соответствующие изомеры наз. геометрическими. Напр., геом. изомеры 1,2-дихлорэтилена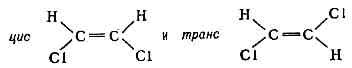 в принципе можно получить один из другого путём поворота вокруг двойной связи С=С на 180°. Однако поскольку энергетич. барьер такого поворота =250 кДж/моль, эти изомеры живут практически бесконечно долго, не превращаясь друг в друга. Геом. изомеры — фактически разные в-ва (хотя формально явл. состояниями одного соединения), обладающие разл. св-вами. Напр., темп-pa кипения цис- и транс-изомеров 1,2-дихлорэтилена равна соотв. 60,1 и 48,4°С.
в принципе можно получить один из другого путём поворота вокруг двойной связи С=С на 180°. Однако поскольку энергетич. барьер такого поворота =250 кДж/моль, эти изомеры живут практически бесконечно долго, не превращаясь друг в друга. Геом. изомеры — фактически разные в-ва (хотя формально явл. состояниями одного соединения), обладающие разл. св-вами. Напр., темп-pa кипения цис- и транс-изомеров 1,2-дихлорэтилена равна соотв. 60,1 и 48,4°С.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ИЗОМЕРИЯ МОЛЕКУЛ
-
(от греч. isos - равный и meros - доля, часть) - существование молекул, обладающих одинаковой молекулярной массой и составом, но различающихся строением или расположением атомов в пространстве. Соответствующие молекулы наз. изомерами. И. м. может быть разбита на два класса: структурную н конформационную. Структурными изомерами наз. соединения, характеризующиеся разными структурными ф-лами при одинаковой брутто-формуле; к о н ф о р м а ц. изомеры (конформеры) различаются пространств, формами одной и той же молекулы. <И. м. была открыта в 1823 Ю. Либихом (J. Liebig), обнаружившим, что серебряная соль гремучей кислоты (Ag-O=N=C) н пзоцпанат серебра (Ag-N=C=О), имеющие брутто-формулу AgCON, обладают разными физ. и хим. св-вамн. Термин "изомерия" предложен в 1830 Й. Я. Берцелиусом (J. J. Berzelius).Для подавляющего большинства структурных изомеров высота барьера DF*, разделяющего равновесные состояния А н В (состояния, отвечающие минимумам свободной энергии F; рис. 1), весьма велика (~102-103 кДж/моль), для конформац. изомеров она, как правило, мала (~1-10 кДж/моль).
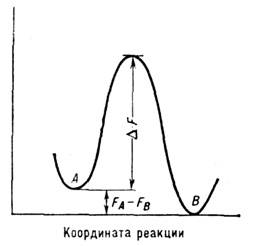
Рис. 1. Схематическое одномерное изображение участка многомерной поверхности свободной энергии изомеров А и В и перехода между ними; по оси абсцисс отложена "координата реакции") - линейная комбинация координат х i, отвечающая движению "по дну оврага", соединяющего локальные минимумы энергии.Константа k скорости перехода между состояниями А и В, равнаячислу переходов в единицу времени, даётся ф-лой Эйринга:
k=(kT/h)exp(-DF*/kT).(1)
Для константы равновесия К, представляющей собой отношение равновесных концентраций А и B, справедливо выражение:
K = [A]/[B] = exp[-(FA-FB)/kT],(2)
где FA-FB- разность свободных энергий состоянии А и В. В выражениях (1) и (2) в свободную энергию входит энергетич. и энтропийный вклады (F=E -TS,E- энергия, S -энтропия). Т. к. ТDS обычно мало, поверхность свободной энергии нередко заменяют потенц. поверхностью. <Из ф-лы (1) следует, что если DF*>100 кДж/моль, то при обычных условиях (при темп-pax порядка комнатной) переходы редки и изомеры присутствуют в виде отдельных хим. соединений. Если же DF*<85-100 кДж/моль, то переходы возникают часто и изомеры неразделимы. Ф-ла (2) характеризует заселённость изомеров. Из неё, в частности, вытекает, что при FA-FB>10кДж/моль заселённость изомера В становится меньше 0,1% (при темп-pax порядка комнатной) и этот изомер с помощью большинства физ. методов обнаружить не удаётся. <Потенц. поверхность многоатомной молекулы многомерна, однако условно её. изображают, откладывая по оси абсцисс "координату реакции", как это показано на рис. 1. Максимум энергетич. кривой в многомерном случае представляет собой седловую точку. Если вычислить гессиан-матрицу Р 2E/ Р xi Р xj вторых производных энергии Eпо независимым координатам х i, х j, то в минимумах энергии все его собственные значения окажутся положительными, а в седловых точках все значения положительны, кроме одного. Путь реакции (путь изомеризации) имеет вид, представленный на рис. 1, только после преобразования координат, при к-ром в качестве "координаты реакции" выбирается координата, отвечающая отрицат. собств. значению гессиана. Заметим, что градиент-вектор с компонентами РE/ Р xi; равен нулю как в точках минимумов энергии, так и в седловых точках. Рассмотренное выше представление путей изомеризации (и др. хим. процессов) осуществляется с помощью борновского приближения, позволяющего рассматривать энергию молекулы как непрерывную ф-цию координат ядер.
Структурная изомерия. Среди структурных изомеров наиб. известны и хорошо изучены изомеры алканов С n Н 2n+2 (рис. 2). Бутан (n=4) имеет два изомера - нормальный бутан (I) и изобутан (II); пентан имеет уже три изомера - нормальный пентан (III), изопентан (IV) и неопентан (V). Далеe с увеличением п число изомеров начинает быстро расти и для n=20 оно составляет уже 366 319. Число структурных изомеров хим. соединений разл. классов можно рассчитать с помощью методов, основанных на теории графов, на полиномах Пойа и пр.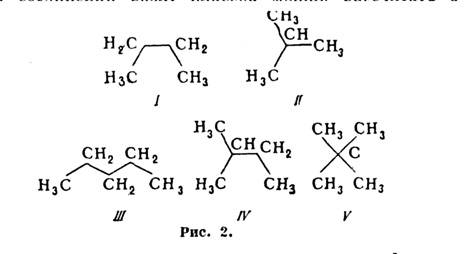
Структурные изомеры могут переходить друг в друга в результате реакций перегруппировки. Если при этом оба изомера присутствуют в достаточно больших кол-вах (т. е. разность FA-FB мала), то такие изомерыназ. таутомерами, а реакция их взаимопревращения - таутомеризацией.
Оптическая изомерия. Особый тип структурной И. м.- оптическая изомерия - возникает в случае, когда молекула содержит киральный центр, напр., тетраэдрич. атом углерода, заместители к-рого могут быть расположены двумя зеркально симметричными способами. Оптич. изомеры (энантиомеры) обладают абсолютно одинаковыми хим. и физ. свойствами, различие между ними проявляется только при их взаимодействии с киральными объектами. В частности, энантиомеры вращают плоскость поляризации света в противоположные стороны. <Абс. конфигурацию асимметрич. центров, взаимное расположение заместителей около них с учётом зеркальной симметрии обозначают буквами D и L, где D соответствует правой, a L - левой конфигурации. Биологически активны только L -аминокислоты, ибо именно они могут встраиваться в молекулы белков и гормонов и "правильно" взаимодействовать с другими макромолекулами и их агрегатами (с ДНК, РНК и пр.).Если в молекуле имеются два асимметрич. центра, то могут возникать 4 конфигурации: DD, DL, LD и LL. Молекулы DD и LL, так же, как LD и DL, эпантиомерны между собой, т. е. являются оптич. изомерами. Но DD и DL, а также LD и LL являются по отношению друг к другу диастереомерами. В силу того, что центры, обладающие разной киральностью, по-разному взаимодействуют между собой, диастереомеры по существу разные соединения: у них различаются темпры плавления и кипения, дииольные моменты, термодинамич. устойчивость, растворимость и др. свойства.
Конформационная изомерия. Конформац. И. м. обычно возникает при вращении к.-л. групп вокруг хим. связей (см. Конформации молекулы). Энергетич. барьеры, разделяющие конформеры, при нормальных темп-pax не превышают ~100 кДж/моль, а времена их жизни ~10-5-10-13 с. Если же величина барьера существенно выше, то взаимопревращения невозможны (статистически крайне редки) и соответствующие изомеры называются уже не конформерами, а геом. изомерами. Геом. изомеры 1,2-дихлорэтилена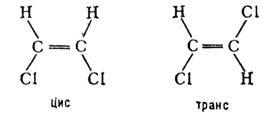
в принципе можно было бы получить один из другого путём поворота вокруг связи С=С на 180°. Однако поскольку энергетич. барьер такого поворота имеет порядок ~250 кДж/моль, эти изомеры живут практически бесконечно долго, не превращаясь друг в друга. Формально геом. изомеры являются состояниями одного и того же соединения, однако фактически это разные вещества, обладающие разл. физ. свойствами. Так, жидкие цис- и транс-изомеры 1,2-дихлорэтилена кипят при темп-рах 60,1 и 48,4 °С соответственно. <Существуют изомеры, к-рые нельзя однозначно отнести к категории конформеров или геом. изомеров в силу того, что барьер, разделяющий состояния А и В, имеет "промежуточную" величину. Так, в замещённых дифенилах
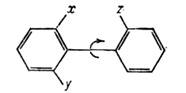
барьер сильно зависит от размера заместителей X, Y, Z, а переходы из одной оптически активной формы в другую могут возникать в большом интервале частот - от 10-5 до 105 с. Когда барьеры достаточно высоки, соответствующие соединения, родственные геометрическим изомерам, наз. атропоизомерами, <а явление носит назв. атропоизомерии; при малых значениях барьера (высокой частоте переходов) состояния А и В соединений этого ряда становятся конформерами. Можно подобрать и такие заместители, при к-рых атропоизомеры превращаются в конформеры о повышением темп-ры. <И. м. доступна для изучения, когда DF>100 кДж/моль, т. е. когда изомеры разделяются, причём для измерения DF, а также для установления временных характеристик переходов между изомерами применяются методы ЯМР, флеш-фотолиза, поглощения УЗ, ЭПР, микроволнового поглощения. В 70-80-х гг. одним из осн. методов изучения изомеризации стал "машинный эксперимент", позволяющий с помощью квантово-хим. приближений, а также в рамках эмпирич. подходов (напр., модели атом-атомных потенц. ф-ций) построить поверхность потенц. энергии молекул (или хотя бы нек-рые её участки), локализовать на ней минимумы и седловые точки. При поиске седловых точек обычно минимизируют в её окрестности норму градиента
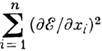
где п - число переменных. Теоретич. <расчёт такого рода даёт информацию не только об энергии в седловой точке, т. е. о высоте барьера изомеризации, но и о структуре переходного состояния. Лит.: Потапов В. М., Стереохимия, М., 1976; Минкин В. И., Олехнович Л. П., Жданов Ю. А., Молекулярный дизайн таутомерных систем. Ростов н/Д., 1977; Сланина 3., Теоретические аспекты явления изомерии в химии, пер. с чеш., М., 1984; Дашевский В. Г., Конформационный анализ макромолекул, М., 1987. В. Г. Дашевский.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
