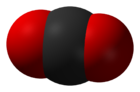
- Оксид углерода(IV)
-
Оксид углерода (IV) _ 

Другие названия углекислый газ, двуокись углерода,
сухой лёд(твердый)Формула CO2 Молярная масса 44,0095(14) г/моль В твердом виде сухой лёд Вид бесцветный газ Номер CAS [124-38-9] Свойства Плотность и фазовое состояние 1,9769 кг/м³, при н.у.;
771 кг/м³, жидкий;
1512 кг/м³, твёрдыйРастворимость в воде 1,45 кг/м³ Удельная теплоемкость 0,846 кДж/(кг*С) при 27 °C Удельная теплота плавления 25,13 кДж/моль Точка плавления −57 °C (216 K), под давлением Точка кипения −78 °C (195 K), возгоняется Константа диссоциации кислоты (pKa) 6,35 и 10,33 Вязкость 0,07 пз при −78 °C Строение Форма молекулы линейная Кристаллическая решётка молекулярная Дипольный момент ноль Техника безопасности MSDS External MSDS Главные опасности удушающее, раздражающее NFPA 704 R-phrases R: As, Fb
S-phrases S9, S23, S36 (ж) RTECS number FF6400000 Страница дополнительных сведений Структура и свойства n, εr, и т. д. Спектр УФ, ИК, ЯМР, Масс-спектроскопия Родственные соединения Оксиды CO
C3O2
стандартных условиях (25 °C, 100 кПа)
Infobox disclaimer and referencesОксид углерода(IV) (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом.
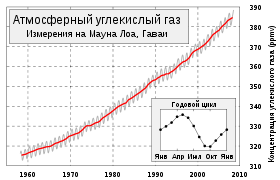
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %.[1]
Не следует путать с Диоксином.
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Содержание
Свойства
Физические
Этот раздел статьи ещё не написан. Согласно замыслу одного из участников Википедии, на этом месте должен располагаться специальный раздел.
Вы можете помочь проекту, написав этот раздел.Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом ) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Однако недостаток углекислого газа тоже опасен (см. Гипокапния).
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя. Смесь полученных газов, промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната, чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его, таким образом, отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
Жидкая углекислота широко применяется в системах пожаротушения, в огнетушителях и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании, а также для накачивания шин/камер велосипедных колес..
Когда углекислота применяется в газовой фазе, то для хранения она используется под давлением, как сжиженный газ, в виде жидкой фазы. Хранение углекислоты в баллоне в сжиженном состоянии намного выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру 31°С. Когда в 40-литровый баллон с нормальным давлением 100 кгс/сm² залито 30 кг сжиженного углекислого газа, то при температуре 31°С в баллоне будет только жидкая фаза с давлением 100 кгс/сm². Если температура будет выше, то следует уменьшить заполнение баллона или использовать баллоны с более высоким рабочим давлением. Если углекислота будет охлаждаться, то при температуре 21°С при нормальном заполнении в баллоне появиться газовая фаза.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле и т.д.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Углекислый газ в природе
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемых топлив (угля, нефти, газа), заметно увеличивающееся в зимний сезон[2].Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность
Углекислый газ является тяжелым, по сравнению с воздухом, газом без цвета и запаха. Воздействие его повышенных концентраций на живые организмы относит его к удушающим газам (англ.)русск.. Незначительные повышения концентрации до 2-4% в непроветриваемых помещениях приводят к развитию сонливости и слабости. Опасными концентрациями считаются уровни 7-10%, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потери сознания в течение периода времени от нескольких минут до одного часа.[3] Отравление этим газом не приводит к долговременным последствиям и после его завершения происходит полное восстановление организма.[4]
Интересные факты
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[5]
- Бо́льшая, по сравнению с человеком, чувствительность других животных к изменениям концентрации этого газа использовалась в качестве естественного детектора опасных концентраций этого газа. Повышенная чувствительность к углекислоте канареек использовалась шахтерами для определения начала скопления этого газа под землей.
- В результате обычного функционирования организма каждого человека в среднем в течение одного дня образуется 1 кг углекислого газа (300 гр углерода).[6]
См. также
Примечания
- ↑ Trends in Carbon Dioxide
- ↑ А. В. Бялко. Растения убыстряют рост. «Природа». No 10, 1996. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. (1967). «Carbon Dioxide Tolerance Studies». Brooks AFB, TX School of Aerospace Medicine Technical Report SAM-TR-67-77. Проверено 2008-05-02.
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
- ↑ (англ.) How much carbon dioxide do humans contribute through breathing?.(недоступная ссылка — история) Проверено 30 апреля 2009.
Литература
- Вукалович М.П., Алтунин В.В., Теплофизические свойства двуокиси углерода, Атомиздат, Москва, 1965. 456 с.
- Тезиков А.Д., Производство и применение сухого льда, Госторгиздат, Москва, 1960. 86 с.
- Гродник М.Г., Величанский А.Я., Проектирование и эксплуатация углеслотных установок, ″Пищевая промышленность″, Москва, 1966. 275 с.
- Талянкер Ю.Е., Особенности хранения баллонов со сжиженным газом, Журнал "Сварочное производство", №11, 1972, Москва.
Ссылки
- International Chemical Safety Card 0021 (англ.)
- CID 280 с сайта PubChem (англ.)
- CO2 Диоксид углерода, свойства, применение (англ.)
- Фазовая диаграмма (давление-температура)для диоксида углерода
- Molview from bluerhinos.co.uk Диоксид углерода в 3D
- Dry Ice information (англ.)
- Trends in Atmospheric Carbon Dioxide (NOAA)
- Phase Diagram of Carbon Dioxide(англ.)
- Experiment 071 — Triple Point Phase Transition for Carbon Dioxide
- CO2 как природный рефрежерант — FAQs (англ.)
- Великобритания разрабатывает метод сохранения двуокиси углерода
- Он-лайн калькулятор свойств CO2 (англ.)
Климат, КлиматологияИзменение климата Палеоклиматология • Эль-Ниньо • Геохимический цикл углерода • Протерозойское оледенение, Ледниковый период, Малый ледниковый период • Термальный максимум (Позднепалеоценовый термальный максимум, Последний ледниковый максимум) • Ледники • Теплооборот Глобальное потепление Вырубка лесов • Противодействие изменению климата • Глобальная климатическая модель • Глобальное похолодание • Глобальное затемнение • Озоновая дыра • Парниковый эффект • Диоксид углерода • Парниковые газы • Межправительственная группа экспертов по изменению климата • Рамочная конвенция ООН об изменении климата (Киотский протокол) • Пик нефти • Возобновляемая энергия • Температурный тренд • Повышение уровня моря • Копенгагенский консенус Оксиды углерода Оксиды CO2 · CO 
Экзотические оксиды Карбонилы металлов · Угольная кислота · Гидрокарбонаты · Карбонаты · Дикарбонаты · Трикарбонаты Категории:- Оксиды углерода
- Пищевые добавки
- Углекислый газ
Wikimedia Foundation. 2010.